
题目列表(包括答案和解析)

为了贯彻“循环经济,防止污染”的理念,某校化学课外活动小组利用废干电池作为再生资源。其实验设计如下:

一、实验目的
从废旧电池中提取有用物质,并检验铵盐的纯度。
二、实验材料
废旧1号电池若干节,钳子等实验用品。
三、实验步骤
1.获取铜帽、锌片、石墨电极
2.从黑色混合物的滤液中提取NH4Cl
3.提取二氧化锰
(1)有关干电池的基本构造和工作原理如右上图。
电池总反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+Mn2O3+H2O,干电池工作时负极上的电极反应式为:______________;正极上产生两种气体,则正极的电极反应式为:________________。
(2)用钳子和剪子剪开回收的干电池的锌筒,把铜帽、锌皮和碳棒回收,将电池内的黑色粉末移入小烧杯中。
(3)氯化铵和氯化锌的提取、检验和分离:
①从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物,主要包括:溶解、_________、蒸发、_________。
②设计简单的实验证明所得晶体中含有 和Zn2+[已知Zn(OH)2是两性氢氧化物且能溶解于氨水生成Zn
和Zn2+[已知Zn(OH)2是两性氢氧化物且能溶解于氨水生成Zn ],并填写下列实验报告。
],并填写下列实验报告。
(a)________,(b)___________,(c)__________,(d)__________,(e)__________,(f)___________。
③最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要硅酸盐质仪器除酒精灯外还有___________。
(4)晶体中氯化铵质量分数的测定:
已知 与HCHO在水溶液中有如下反应:4
与HCHO在水溶液中有如下反应:4 +6HCHO→(CH2)6N4+4H++6H2O。称取ag样品溶于水,加入足量的HCHO溶液,配成100mL溶液,再取出10mL,滴入酚酞后,再逐滴滴入cmol/L的NaOH溶液,当滴到VmL时,溶液呈现粉红色,整个过程中不考虑杂质参与反应,则晶体中氯化铵的质量分数ω(NH4Cl)为___________。
+6HCHO→(CH2)6N4+4H++6H2O。称取ag样品溶于水,加入足量的HCHO溶液,配成100mL溶液,再取出10mL,滴入酚酞后,再逐滴滴入cmol/L的NaOH溶液,当滴到VmL时,溶液呈现粉红色,整个过程中不考虑杂质参与反应,则晶体中氯化铵的质量分数ω(NH4Cl)为___________。
(A)我国化学家候德榜(右下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1) 上述生产纯碱的方法称 ,副产品的一种用途为 。
(2) 沉淀池中发生的化学反应方程式是 。
(3) 写出上述流程中X物质的分子式 。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(a) 增大NH4+的浓度,使NH4Cl更多地析出
(b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
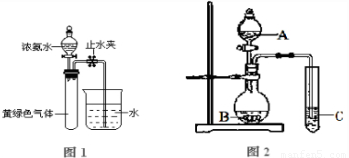
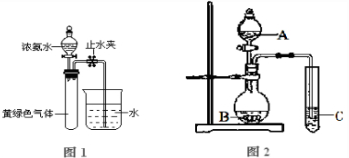
(B)某化学课外小组用下图装置制取溴苯。

先向分液漏斗中加入苯和液溴 ,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式
(2)观察到A中的现象是 。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 ,写出有关的化学方程式 。
(4)C中盛放CCl4的作用是 。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入 ,现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com