
题目列表(包括答案和解析)
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A.1/2 N2H4(g)+1/2O2(g)===1/2 N2(g)+H2O(g) ΔH=+267 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1
D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:N2(g)+2O2(g)=2NO2(g)? ΔH=+67.7kJ/mol, 2N2H4(g)+2NO2(g)=3N2(g) +4H2O(g) ΔH=-1135.7kJ/mol,下列说法正确的是
A.N2H4(g)+O2(g)=N2(g)+2H2O(g)? ΔH=-1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5+ + OH-
C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大
发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是( )
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C.N2H4(g) + NO2(g) =3/2N2(g) + 2H2O(l);△H = – 1135.7kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol
(15分)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。
(1)已知在25℃,101kPa时,16.0g N2H4在氧气中完全燃烧生成氮气,放出热量312kJ,N2H4完全燃烧反应的热化学方程式是 。
肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是: 。电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(2)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。如果A是铂电极,B是石墨电极,C是500mL足量的饱和氯化钠溶液,当两极共产生1.12L气体时,溶液的pH为 ,
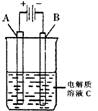
则肼-空气燃料电池理论上消耗的空气 L(气体体积在标准状况下测定,假设空气中氧气体积分数为20%)
(3)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(4)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+) 0.1
mol/L HCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”)。
(5)已知:在相同条件下N2H4·H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2
mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H+5、Cl-、OH-、H+
离子浓度由大到小的顺序为 。
2005年10月12日我国成功发射了第二艘载人航天飞船――“神州六号”,实现了双人多天太空旅行。这标志着中国人的太空时代又前进了一大步。发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是( )
A、2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = 1135.7kJ/mol
B、2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = 1000.3kJ/mol
C、N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H = 1135.7kJ/mol
D、2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = 1135.7kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com