
题目列表(包括答案和解析)
(20分)A物质是实验室一种无色有毒的挥发性液体,由X、Y两种短周期元素组成。A在空气中极易着火生成B气体和C气体;A不溶于水,但加热到423K可以和水反应,生成B气体和D气体,D只含两种元素,其中一种是Y。在交流放电的情况下,分解生成E气体、F固体两种物质,E物质和B化学式量几乎相等,含Y元素约72.7%;F是环状单质分子,具有冠状结构,易溶于A,F的式量约是C的4倍。E可在液氮条件下与HBr于77K生成含双键结构的物质G,冷却至室温可得G的环状三聚体H。
6-1 写出A、B、C、D、E、F、G、H的结构简式。
6-2 用X射线衍射法测得F的晶体为正交晶系,晶胞参数a=1048pm,b=1292pm,c=2455pm。已知该物质的密度为2.07g?cm-3。计算每个晶胞中F分子的数目。
6-3 自发现富勒烯以来,其神奇的结构和性能引起了人们对碳原子团簇广泛和深入的研究。除了碳原子团簇之外,其它元素的原子团簇是否也具有类似碳原子团簇的奇异的特性,这是个十分有趣的研究课题。F物质有很多同分异构体,在实验手段受到各种条件的限制时,理论研究是一种重要的补充。厦门大学化学系对F物质的原子团簇进行了理论计算,发现除了冠状结构外还有多种结构。其中一种X具有2次对称轴,以及两个包含对称轴的对称面,一配位和三配位原子数目相等;另外一种Y是一种椅式结构原子团簇增加2个原子形成,也具有二次对称轴,对称面和对称轴垂直。请画出这两种结构的原子团簇。
6-4 五氟化砷AsF5(2.93g)和上述物质F(0.37g)用四氮化四硫S4N4(0.53g)在液态SO2溶剂中发生完全的反应,溶剂和挥发性产物被泵抽出后得黄色固体残留物L(3.08g),分析J知其含有:As 28.04%,F 42.70%,N 5.25%,经分析L是离子化合物,阴离子为正八面体结构,阳离子为两种元素组成,结构是直线形。固体L(0.48g)溶于液态二氧化硫,和叠氮化铯Cs+N3-(0.31g)完全反应,收集应释放出得氮气于66.5kPa、298K为67.1cm3。反应混合物过滤得难溶蓝黑色纤维状固体J(0.16g)。分析J知其含有2种元素,其中含N 30.3%。红外光谱、X射线粉末衍射结果表明抽出SO2后残留物是六氟砷(V)酸铯。
(1)L的实验式是什么?
(2)提出L的结构式;
(3)写出配平的生成L的方程式;
(4)1mol L发生转化时生成氮气的物质的量;
(5)J的化学式;
(6)写出n mol L生成J的普遍离子方程式。
(1)钛元素的同位素有:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。下列说法中正确的是( )
。下列说法中正确的是( )
A.据此可计算出钛元素的相对原子质量为48
B.钛元素的五种同位素化学性质均不相同
C.钛元素在元素周期表中位于第四周期
D.钛与26Fe同为第Ⅷ族元素
(2)TiO2是高级的白色颜料,它的制取方法如下:
第一步:使钛铁矿与硫酸反应,FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O,此时,钛铁矿中的Fe2O3也与H2SO4发生反应,可加入铁屑使将生成的Fe3+还原成Fe2+。写出此还原过程的离子反应方程式:______________________________________________________。
TiOSO4+FeSO4+2H2O,此时,钛铁矿中的Fe2O3也与H2SO4发生反应,可加入铁屑使将生成的Fe3+还原成Fe2+。写出此还原过程的离子反应方程式:______________________________________________________。
第二步:水解,TiOSO4+2H2O![]() TiO2·H2O+H2SO4 ΔH>0。
TiO2·H2O+H2SO4 ΔH>0。
制TiO2的关键是第二步水解反应。为使第二步水解反应进行得更完全,可采用下列_______措施。
A.加酸 B.加碱 C.加热 D.加压
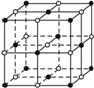
(3)最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示,顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子。则它的化学式为__________________________。
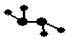 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题: 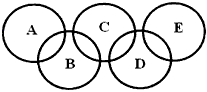
(12分)
A.原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈 ____ 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______ __________________ 。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
|
|
| A-B | A=B | A≡B |
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 |
(5)它们的分子中都包含___________个σ键,______________个π键。
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为 _____ 。Fe(CO)5常温下呈液态,熔点为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ____(填晶体类型);Fe(CO)5是配合物,配体是__________ 。
B.茶中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6~7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、 ___ 、 ____ 等仪器。
步骤2中,改用试剂 _______ (写试剂名称)来调节pH将更为方便;判断沉淀已经洗净的方法是 。
步骤3中,滴定过程中,眼睛应注视 ____________________,被滴定的20 mL滤液中含CO32-的物质的量为 __ mol,试计算原500g茶叶中钙离子的质量分数为 _______ ,计算过程如下:
(12分)
A.原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈 ____ 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______ __________________。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
| | | A-B | A=B | A≡B |
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 | |||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com