
题目列表(包括答案和解析)
氢气在化学工业中有广泛用途。
(1)实验室用锌和稀硫酸制取氢气,反应过程中,溶液中水的电离平衡______移动(填“向左”、“向右”或“不”);若加入少量的_________(填编号),产生氢气速率加快。
A.NaNO3 B.CuSO4 C.CH3COONa D.NaHSO3
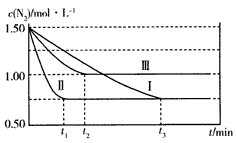
工业合成氨的反应原理为N2(g)+3H2(g) 2NH3(g)。实验室模拟化工生产,控制起始浓度均为
2NH3(g)。实验室模拟化工生产,控制起始浓度均为
c(N2)= 1.50 mol/L、c(H2)=2.50 mol/L,分别在三种不同实验条件下反应,N2浓度随时间变化如下图。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com