
题目列表(包括答案和解析)
某盐溶液中可能含有NH4+、Ba2+、Na+、Fe2+、Cl—、CO32—、NO3—七种离子中的数种。某同学取4份此溶液样品,分别进行了如下实验:(硝酸具有强氧化性,可以氧化Fe2+、I-、S2-、SO32—等等)
①用pH试纸测得溶液呈强酸性;
②加入 过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;
过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;
③加入硝酸酸化的AgNO3溶液产生白色沉淀;
④加足量BaCl2溶液,没有沉淀产生,在溶液中加入氯水,再滴加KSCN溶液,显红色
该同学最终确定在上述七种离子中肯定含有NH4+、Fe2+、Cl—三种离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A.①②④ B.①② C.①②③④ D.②③④
(1)(3分)食品和药品关系人的生存和健康。
①市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是 (填字母)。
A.加锌盐 B.加碘盐 C.加钙盐
②纤维素被称为“第七营养素”。食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质。从化学成分看,纤维素是一种 (填字母)。
A.多糖 B.蛋白质 C.脂肪
③某同学感冒发烧,他可服用下列哪种药品进行治疗 (填字母)。
A.麻黄碱 B.阿司匹林 C.抗酸药
(2)(5分)材料是人类赖以生存和发展的重要物质基础。
①生产硅酸盐水泥和普通玻璃都需用到的共同的主要原料是 。
②生活中有大量的铝制品。 家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示) 。
家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示) 。
③有机玻璃受热时会软化, 易于加工成型。有机玻璃是一种 材料(选填“硅酸盐”或“纤维”或“塑料”)。导电塑料的结构可表示为
易于加工成型。有机玻璃是一种 材料(选填“硅酸盐”或“纤维”或“塑料”)。导电塑料的结构可表示为 ,则其单体的结构简式为 。
,则其单体的结构简式为 。
(3)(7分)保护环境、保护地球是人类共同的呼声。
①向煤中加入石灰石作为脱硫剂,可以减少煤燃烧时产生的SO2。发生反应的化学方程式为 。
②天然水中含有的细小悬浮颗粒可以用 做混凝剂(写名称)进行净化处理。工业废水中含有的Cr3+离子,可用熟石灰作沉淀剂,在pH为8~9时生成沉淀而除去,该反应的离子方程式是 。
③城市餐饮业会产生大量污染环境的“地沟油”。“地沟油”的主要成分是油脂。综合利用“地沟油”的一种方法是将“地沟油”中的油脂水解以获取甘油和 。生活中会产生大量废弃塑料,将废弃塑料进行 处理,可以获得乙烯、丙烯等化工原料。
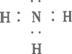
(1)在实验室用集气瓶收集气体G和气体H。则收集气体G的方法是(写一种):__________
__________;检验气体H已收集满的方法是:__________。
(2)在实验室进行操作①时,除了使用酒精灯、铁圈、铁架台及夹持仪器外,还缺少的仪器是:____________;在进行操作②时,应在HCl的气氛中加热脱水,其目的是:__________。
(3)A+H2O![]() B+H的基本反应类型为__________,H的电子式为__________。
B+H的基本反应类型为__________,H的电子式为__________。
(4)如下图所示支管中,左管中放入MnO4固体,右管中放入小块钠,再向两管均加入适量8 mol·L-1的盐酸,半分钟后,盖上橡胶塞并将此支管固定在铁架台上。用一照相机对准此支管,按快门,闪光灯闪亮。请回答:
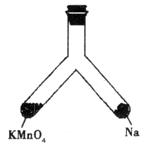
①“照相”之前,左管中反应生成的气体是__________(写化学式),若生成0.5 mol该气体,则转移电子的物质的量是__________mol。
②“照相”时,灯光闪亮,支管随之出现的现象是__________。

(12分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
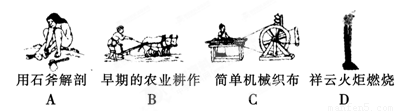
(1)下列生产、生活中的事例中发生了氧化还原反应的是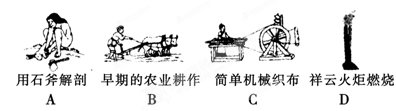
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。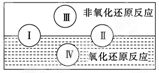
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
其中水为________剂。
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为__________________________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
________Cu2S+________Fe3++______H2O________Cu2++________Fe2++________( )+________SO42-。
(4)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是 。
(12分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中发生了氧化还原反应的是
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
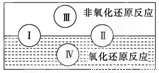
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
其中水为________剂。
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为__________________________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
________Cu2S+________Fe3++______H2O________Cu2++________Fe2++________( )+________SO42-。
(4)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com