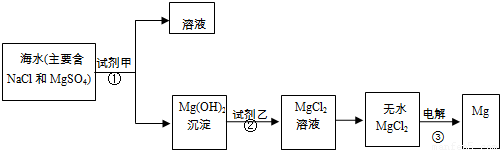
目前世界上60%的镁是从海水中提取的,某校学生设计从海水中提取镁的实验流程如下图.请思考并回答:
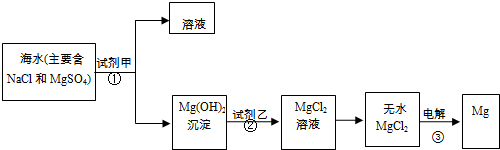
I.上述实验过程中涉及的①、②、③反应属于氧化还原反应的是______(填序号).
II.从海水中提取镁的过程中,为实现对镁离子的富集,有三种预设方案:
A.直接往海水中加沉淀剂;
B.加热蒸发海水后,加入沉淀剂;
C.利用晒盐后的苦卤水,加入沉淀剂.
通过分析比较,你认为方案______正确(填序号),其理由是______.
III.从海水中提取镁的过程中,另一重要的环节是实现对Mg
2+的分离.
(1)为了使镁离子完全沉淀下来,若加入足量的试剂甲为澄清的石灰水,其反应的离子方程式为______.
(2)加入试剂甲后,能够分离得到Mg(OH)
2沉淀的方法是______(填实验操作名称).

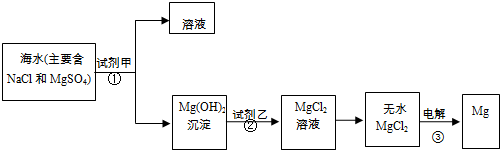
 Mg+Cl2↑
Mg+Cl2↑ 2Mg+O2↑
2Mg+O2↑