
题目列表(包括答案和解析)
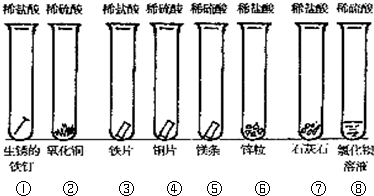
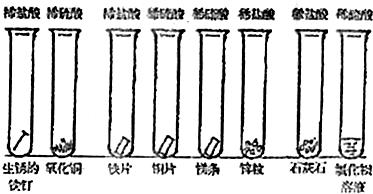
 (2010?祁阳县一模)某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究:
(2010?祁阳县一模)某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究:| 物质 | 性质 | 物质 | 性质 |
| 氯化铜 | 浓溶液呈绿色,稀溶液呈蓝色 | 氯化亚铜 | 白色 |
| 氧化亚铜 | 砖红色,在酸性条件下易反应: Cu2O+2H+=Cu+Cu2++H2O. Cu2O在空气中灼烧生成CuO |
氢氧化亚铜 | 橙黄色,不稳定 |
| ||
| ||
(10分)某工业废水中仅含下表离子中的5种,且各种离子的物质的量浓度相等,均为0.1mol/L。
|
阳离子 |
K+ Cu2+ Fe3+ Al3+ Fe2+ |
|
阴离子 |
Cl- CO32- NO3- SO42- SiO32- |
欲探究废水的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ. 向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)仅由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是 (写离子符号)。
(2)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为:
___________________________________
(3)原溶液中所含阳离子是 ,阴离子是 。(写离子符号)
【解析】I中说明没有K+,Ⅱ中说明没有Fe3+。无色气体遇空气变成红棕色,说明该无色气体是NO,即加入盐酸后发生了氧化还原反应,而所给离子中只有亚铁离子可以被硝酸氧化,因此一定含有亚铁离子和NO3-。又因为溶液依然澄清,且溶液中阴离子种类不变,所以溶液中不能含有CO32-和SiO32-。Ⅳ说明含有SO42-,因为浓度均是0.1mol/L,且只有5种离子,所以若铜离子和铝离子同时存在,则不能满足溶液呈电中性,所以二者只能含有一种,因此氯离子必须存在。根据离子的浓度大小可以判断,铜离子存在,铝离子不能存在。
(10分)某工业废水中仅含下表离子中的5种,且各种离子的物质的量浓度相等,均为0.1mol/L。
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
欲探究废水的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)仅由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是 (写离子符号)。
(2)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为:
___________________________________
(3)原溶液中所含阳离子是 ,阴离子是 。(写离子符号)
【解析】I中说明没有K+,Ⅱ中说明没有Fe3+。无色气体遇空气变成红棕色,说明该无色气体是NO,即加入盐酸后发生了氧化还原反应,而所给离子中只有亚铁离子可以被硝酸氧化,因此一定含有亚铁离子和NO3-。又因为溶液依然澄清,且溶液中阴离子种类不变,所以溶液中不能含有CO32-和SiO32-。Ⅳ说明含有SO42-,因为浓度均是0.1mol/L,且只有5种离子,所以若铜离子和铝离子同时存在,则不能满足溶液呈电中性,所以二者只能含有一种,因此氯离子必须存在。根据离子的浓度大小可以判断,铜离子存在,铝离子不能存在。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com