
题目列表(包括答案和解析)
(14分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
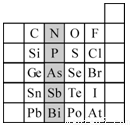
(1)阴影部分元素N在元素周期表中的位置为 。
根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为______,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 (选填“更大”、“更小”或“相同”) 。
(3)O原子与氢原子可形成10电子阴离子,写出该阴离子的电子式
(4)Cl2、Br2、I2均可从中海洋提取,Br2的提取是采用向酸化的浓海水中通入Cl2置换出Br-的方法而获得,有关的离子方程式为 ,利用Br2具有较强的氧化性,SO2具有较强的还原性,将吹出的Br2通入溶有SO2气体的溶液中,进行溴的富集,此时溶液中存在的主要离子是____________________________。
(14分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
(1)阴影部分元素N在元素周期表中的位置为 。
根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为______,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 (选填“更大”、“更小”或“相同”) 。
(3)O原子与氢原子可形成10电子阴离子,写出该阴离子的电子式
(4)Cl2、Br2、I2均可从中海洋提取,Br2的提取是采用向酸化的浓海水中通入Cl2置换出Br-的方法而获得,有关的离子方程式为 ,利用Br2具有较强的氧化性,SO2具有较强的还原性,将吹出的Br2通入溶有SO2气体的溶液中,进行溴的富集,此时溶液中存在的主要离子是____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com