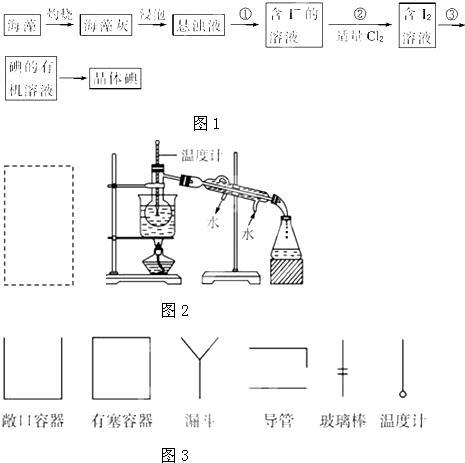
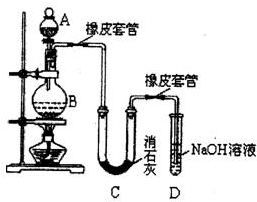
某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:
I. 取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu
2(OH)
2CO
3].
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状.
Ⅲ.按如图所示装置连接仪器、检查气密性、装入化学试剂.
(1)过程I发生反应的离子方程式是
Cu2(OH)2CO3+4H+═2Cu2++CO2↑+3H2O
Cu2(OH)2CO3+4H+═2Cu2++CO2↑+3H2O
.
(2)写出过程Ⅲ中检查气密性的方法
打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好
打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好
.
(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是
产生红棕色气体
产生红棕色气体
,一段时间后使反应停止的操作是
轻轻将注射器活塞向右拉使铜丝和溶液分开
轻轻将注射器活塞向右拉使铜丝和溶液分开
,关闭a,取下注射器.
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生.稀硝酸充满玻璃管的实验目是
将玻璃管中的NO2和空气排出
将玻璃管中的NO2和空气排出
,该反应的离子方程式是
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.
(4)另取3支盛满NO
2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致.结果如表所示(忽略温度对气体体积的影响):
| 实验编号 |
水温/℃ |
液面上升高度 |
| 1 |
25 |
超过试管的 |
| 2 |
50 |
不足试管的 |
| 3 |
0 |
液面上升超过实验1 |
①根据上表得出的结论是温度越
低
低
(填“高”或“低”),进入试管中的溶液越多.
②查阅资料:
a.NO
2与水反应的实际过程为:2NO
2+H
2O=HNO
3+HNO
2 3HNO
2=HNO
3+2NO↑+H
2O;
b.HNO
2不稳定.
则产生上述现象的原因是
温度低,HNO2分解量减少,分解产生的NO气体量减少,所以进入试管的溶液多
温度低,HNO2分解量减少,分解产生的NO气体量减少,所以进入试管的溶液多
.

 某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:
某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示: 煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源.
煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源.