
题目列表(包括答案和解析)
 某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,应逐渐减慢甚至停止.
某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,应逐渐减慢甚至停止.| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
| 气体体积( mL) | 35 | 47 | 55 | 51 | 42 |
| 试管编号 | A | B | C | D | E |
| 温度 (℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和比较 | 有少量气泡 | 气泡比A号试管多 | 气泡明显比B试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
| 装置A | 装置B | |
| 长玻璃导管中现象 | 红墨水在长玻璃管中上升较快 红墨水在长玻璃管中上升较快 |
红墨水在长玻璃管中上升较慢 红墨水在长玻璃管中上升较慢 |
某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制
取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,应逐渐减慢甚至停止。
学校实验小组设立研究课题:选择合适浓度的硫酸和适当的反应温度制取二氧化碳。
【实验一】选择合适浓度的硫酸
操作:在28℃时.用装有5mL硫酸溶液的注射器向盛有lg直径为2mm大理石的大试管中注入硫酸,
记录15分钟内生成气体的体积,见下表:
| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度( %) | 15 | 20 | 25 | 30 | 35 |
| 气体体积( mL) | 35 | 47 | 55 | 51 | 42 |
【实验二】选孚合适反应温度
操作:往盛有lg直径为2mm大理石的大试管中分别加入5mL相同合适浓度而不同温度的硫酸溶液,观察反应的情况,记录如下表:
| 试管编号 | A | B | C | D | E |
| 温度 (℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和比较 | 有少量气泡 | 气泡比A号试管多 | 气泡明显比B试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
请根据本次活动的研究目的,分析处理以上两个表中数据,得出结论:
问题分析:
(1)稀硫酸与大理石反应,在28℃时,选用硫酸的浓度最合适为________%,其理由是____________
____________________________________________________________________________________。
(2)当硫酸浓度一定时,反应速度与温度之间存在的关系是____________________________________
__________________________________________________________,请你从微粒的角度分析出现这种反应规律的原因可能是____________________________________________________________。
其中最合适用于实验室制取二氧化碳的反应温度为____ ℃。
(3)拓展研究:
[提出问题]影响化学反应速率还受什么因素影响?
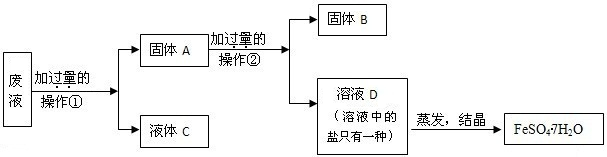
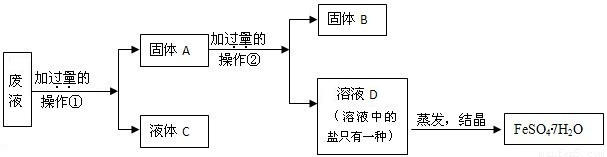
[实验装置]如右图所示:
a.装置中红墨水的作用是____________________________________。
b.装置中长玻璃导管的作用是____________________________________。
[实验验证]
| 装置A | 装置B | |
| 长玻璃导管中现象 | ____________________________________________________ |
|
通过本实验研究中变量是:______________________________________________________,所以可以得出的结论是“_______________________________________________化学反应的速率越快”。
 |
| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
| 气体体积( mL) | 35 | 47 | 55 | 51 | 42 |
| 试管编号 | A | B | C | D | E |
| 温度 (℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和比较 | 有少量气泡 | 气泡比A号试管多 | 气泡明显比B试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
| 装置A | 装置B | |
| 长玻璃导管中现象 | ______ | ______ |

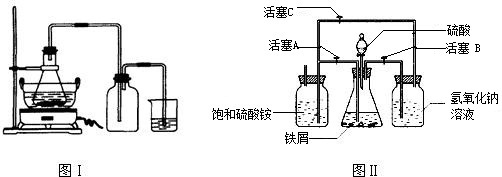
| 序号 | 反应物用量(n表示微粒个数) | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于1级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于1级 |
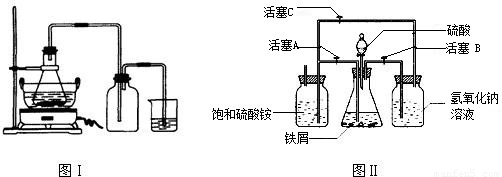
| 序号 | 反应物用量(n表示微粒个数) | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于1级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于1级 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com