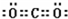W、X、Y、Z是原子序数依次增大的短周期元素.W的最外层电子数是电子层数的2倍.Y是金属,可以和X形成1:1和2:1两种化合物.Z的最高正价与最低负价的代数和为4.
(1)写出WX
2的电子式
.
(2)用元素符号表示X、Y、Z原子半径由大到小的顺序
Na>S>O
Na>S>O
.
(3)含1molZ的最高价氧化物对应水化物的稀溶液与足量Y的最高价氧化物对应水化物的稀溶液反应放出热量114.6kJ,写出此反应的热化学方程式:
2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ/mol
2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ/mol
.
(4)100ml1mol/LY的最高价氧化物对应水化物的稀溶液中通入标准状况下1.12LWX
2,反应后溶液呈
碱
碱
性,原因是(用离子方程式解释):
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
.
(5)Y
2ZX
4与WX、H
2在高温和铁做催化剂条件下反应,0.1mol Y
2ZX
4参加反应转移0.8mol电子,消耗标况下H
2的体积为4.48L,该反应的化学方程式为
Na
2SO
4+2CO+2H
2Na
2S+2CO
2+2H
2O
Na
2SO
4+2CO+2H
2Na
2S+2CO
2+2H
2O
.