(1)某化学兴趣小组通过实验来实现电能转化成化学能,他们在U形管中加入适量饱和氯化铜溶液,用石墨棒作电极,接通直流电源开始实验.
①与电源正极相连的是电解池的
阳
阳
极,该极发生的电极反应式为
2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
.检验该极上产物的实验方法及现象是
将湿润的淀粉碘化钾试纸放在该极U形管口附近,试纸变蓝
将湿润的淀粉碘化钾试纸放在该极U形管口附近,试纸变蓝
.
②电解反应的化学方程式为
.
(2)某学生用手电筒使用的干电池、小灯泡和石墨电极、导线等连接起来进行氯化钠的导电性实验,当将石墨电极插入干燥的氯化钠晶体中时,灯泡没有亮;而将石墨电极插入熔融的氯化钠中时,灯泡亮了.由此你能得到结论是
①熔融的氯化钠能导电、②熔融的氯化钠才能导电,而干燥的氯化钠晶体不能导电
①熔融的氯化钠能导电、②熔融的氯化钠才能导电,而干燥的氯化钠晶体不能导电
;您对这些结论的解释是
结论①是因为熔融的氯化钠中有自由移动的带电的微粒,根据组成,带电的微粒只能是氯离子、钠离子.
结论②是因为在干燥的氯化钠晶体中氯离子与钠离子之间有强烈的相互作用而不能自由移动
结论①是因为熔融的氯化钠中有自由移动的带电的微粒,根据组成,带电的微粒只能是氯离子、钠离子.
结论②是因为在干燥的氯化钠晶体中氯离子与钠离子之间有强烈的相互作用而不能自由移动
.



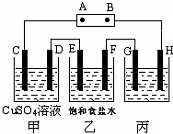 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、G、H 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、G、H 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题: