
题目列表(包括答案和解析)
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示)。

(1)制备实验开始时,先检查装置气密性,接下来的操作依次是__________(填序号)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
制备反应会因盐酸浓度下降而停止。为测定已分离出过量MnO2后的反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:与已知量CaCO3(过量)反应,称量剩余固体的质量。
丙方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
(2)判定甲方案不可行,理由是______________________________________________________。
(3)乙方案的实验发现,固体中含有MnCO3,说明碳酸钙在水中存在__________________,测定的结果会:______________________(填“偏大”、“偏小”或“准确”)。
进行丙方案实验:装置如图所示(夹持器具已略去)。
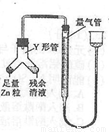
(4)使Y形管中的残余清液与锌粒反应的正确操作是将________转移到______中。
(5)反应完毕,每间隔1分钟读取气体体积,发现气体体积逐渐减小,直至不变。 气体体积逐次减小的原因是____________(排除装置和实验操作的影响因素)。
(6)小组内又有同学提出还可采用酸碱中和滴定法测定残余液中盐酸的浓度,但还需经查阅资料知道:________________________________________________________ 。
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示)。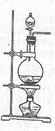
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是__________(填序号)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
制备反应会因盐酸浓度下降而停止。为测定已分离出过量MnO2后的反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:与已知量CaCO3(过量)反应,称量剩余固体的质量。
丙方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
(2)判定甲方案不可行,理由是______________________________________________________。
(3)乙方案的实验发现,固体中含有MnCO3,说明碳酸钙在水中存在__________________,测定的结果会:______________________(填“偏大”、“偏小”或“准确”)。
进行丙方案实验:装置如图所示(夹持器具已略去)。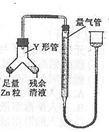
(4)使Y形管中的残余清液与锌粒反应的正确操作是将________转移到______中。
(5)反应完毕,每间隔1分钟读取气体体积,发现气体体积逐渐减小,直至不变。 气体体积逐次减小的原因是____________(排除装置和实验操作的影响因素)。
(6)小组内又有同学提出还可采用酸碱中和滴定法测定残余液中盐酸的浓度,但还需经查阅资料知道:________________________________________________________ 。
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如右图所示)。
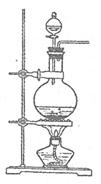 (1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)
A.往烧瓶中加人MnO2粉末 B.加热 C.往烧瓶中加人浓盐酸
 (2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是 。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为 mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3 ) = 2.8×10-9、Ksp(MnCO3 ) = 2.3×10-11
④ 进行丁方案实验:装置如右图所示(夹持器具已略去)。
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将 转移到
中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)。

| 实验 序号 |
铁的 质量/g |
铁的 形态 |
c/(H2SO4) /mol?L-1 |
V(H2SO4) /mL |
溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 铁片 | 0.7 | 50 | 20 | 36 | 250 |
| 2 | 0.10 | 铁片 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 铁粉 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 铁片 | 1.0 | 50 | 20 | 35 | 125 |
| 5 | 0.10 | 铁片 | 1.0 | 50 | 35 | 50 | 50 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com