
题目列表(包括答案和解析)
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1| n(SO32-):n(HSO3-) | 91:9 | 1:l | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |

| 催化剂 |
| 8 |
| 3 |
| 8 |
| 3 |
诸葛亮未解奥秘——硫酸铜
《三国演义》中有这样一个故事:诸葛亮第四次释放孟获后,孟获逃至秃龙洞,秃龙大王便扬言要借用四个毒泉消灭汉军。四毒泉中有一个叫“哑泉”,“人若饮之,则不能言,不过旬日必死。”不久,汉军先锋王平率数百军士前头探路,由于当时天气炎热,人马均争先恐后地误喝了哑泉之水。回到大营后大难果至,军士们个个瞠目闭舌,说不出话来,生命也危在旦夕。诸葛亮面对此景,也束手无策。幸运的是,一老头从此处经过,经其指点,汉军众将士急忙饮了万安溪安乐泉水,方逐渐转危为安,渡过了难关。
“哑泉”之奥秘何在?经当代化学工作者实地分析研究,才弄清了个中缘由。原来,哑泉水中含有大量的硫酸铜,人喝了含有铜盐的水就会中毒,引起说话不清,呕吐腹泻,最后导致虚脱、痉挛而死。而万安溪安乐泉水中含有较多的碱,人误食含有硫酸铜的食物或喝了含有硫酸铜的水之后,再喝万安溪安乐泉水,其中的碱既能中和胃酸又能与硫酸铜发生化学反应,致使原来被人体吸收的可溶性硫酸铜转变成了不溶性的氢氧化铜沉淀,这种沉淀不易被人体吸收,所以对人体不会再产生危害。
要是聪明的诸葛亮具备了一定的化学科学素养,相信他当时就不会束手无策了。
思考:写出以上材料中发生的离子反应方程式。
Ⅰ.沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是可持续发展的重要保证。
 (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式???????????????????????????????? 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式???????????????????????????????? 。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入?????????? (选填“Na2S”或“NaOH”)效果更好。
难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
(3)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:

①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因????????? (任写一个)。
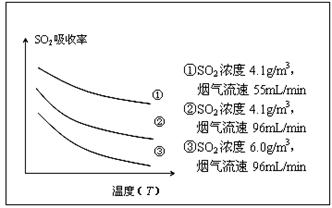
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示。

请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:??? 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是?????????????????? (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是???????????????????????? 。
Ⅱ.能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式
①2H2(g)+O2(g)=2H2O(l)????  H=-570kJ/mol;
H=-570kJ/mol;
②H2(g)+1/2O2(g)=H2O(g)???  H=-242kJ/mol;
H=-242kJ/mol;
③C(s)+1/2O2(g)=CO(g)????  H=—110.5kJ/moL;
H=—110.5kJ/moL;
④C(s)+O2(g)=CO2(g)???????  H=—393.5kJ/moL;
H=—393.5kJ/moL;
⑤CO2(g)+2H2O(g)=2CH4(g)+2 O2(g)?  H=+890kJ/moL
H=+890kJ/moL
回答下列问题
(1)上述反应中属于吸热反应的是??????????????? 。
(2)H2的燃烧热为△H=??????????????? 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)=H2(g)+ CO(g)????  H=akJ/moL;则a=???????? ;该反应的熵
H=akJ/moL;则a=???????? ;该反应的熵 S???????? 0(选填“>”、“=”、“<”);已知自由能
S???????? 0(选填“>”、“=”、“<”);已知自由能 G=
G= H—T
H—T S,当
S,当 G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
(4)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是????? 。

A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2—由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
Ⅰ.沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是可持续发展的重要保证。 (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入 (选填“Na2S”或“NaOH”)效果更好。
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |

 H=-570kJ/mol;
H=-570kJ/mol; H=-242kJ/mol;
H=-242kJ/mol; H=—110.5kJ/moL;
H=—110.5kJ/moL; H=—393.5kJ/moL;
H=—393.5kJ/moL; H=+890kJ/moL
H=+890kJ/moL H=akJ/moL;则a= ;该反应的熵
H=akJ/moL;则a= ;该反应的熵 S 0(选填“>”、“=”、“<”);已知自由能
S 0(选填“>”、“=”、“<”);已知自由能 G=
G= H—T
H—T S,当
S,当 G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
G<0时可自发进行。则该反应在什么条件下可自发进行__________________。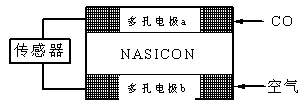
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com