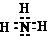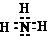(2013?浙江)氢能源是一种重要清洁能源.现有两种可产生H
2的化合物甲和乙.将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L的H
2(已折算成标准状况).甲与水反应也能放出H
2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液.化合物乙在催化剂存在下可分解得到H
2和另一种单质气体丙,丙在标准状况下的密度为1.25g?L
-1.请回答下列问题:
(1)甲的化学式是
AlH3
AlH3
;乙的电子式是
.
(2)甲与水反应的化学方程式是
AlH3+3H2O=Al(OH)3↓+3H2↑
AlH3+3H2O=Al(OH)3↓+3H2↑
.
(3)气体丙与金属镁反应的产物是
Mg3N2
Mg3N2
(用化学式表示).
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式
.有人提出产物Cu中可能还混有Cu
2O,请设计实验方案验证之
取样后加H2SO4,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O
取样后加H2SO4,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O
.(已知:Cu
2O+2H
+═Cu+Cu
2++H
2O)
(5)甲与乙之间
可能
可能
(填“可能”或“不可能”)发生反应产生H
2,判断理由是
AlH3中的H为-1价,NH3中的H为+1价,有可能发生氧化还原反应生成氢气
AlH3中的H为-1价,NH3中的H为+1价,有可能发生氧化还原反应生成氢气
.