
题目列表(包括答案和解析)
硫酸铜是一种重要的硫酸盐,在工农业生产中有着重要的应用。
回答下列问题:
(1)写出基态Cu2+的核外电子排布式 。
(2)SO42-中S原子的杂化轨道类型是 ;与SO42-互为等电子体的一种微粒是 。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:
①胆矾中含有的粒子间作用力是 (填序号)。
a. 离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
②在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1molCN-中键的数目为 。
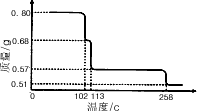
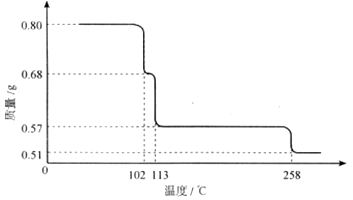
③胆矾受热分解得到铜的某种氧化物,其晶胞结构如图所示,则氧的配位数是 。
硫酸铜是一种重要的硫酸盐,在工农业生产中有着重要的应用。
回答下列问题:
(1)写出基态Cu2+的核外电子排布式 。
(2)SO42-中S原子的杂化轨道类型是 ;与SO42-互为等电子体的一种微粒是 。
(3) 胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:
胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:
①胆矾中含有的粒子间作用力是 (填序号)。
离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
②在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1molCN-中 键的数目为 。
键的数目为 。
③胆矾受热分解得到铜的某种氧化物,其晶胞结构如图所示,则氧的配位数是 。
硫酸铜是一种重要的硫酸盐,在工农业生产中有着重要的应用。
回答下列问题:
(1)写出基态Cu2+的核外电子排布式 。
(2)SO42-中S原子的杂化轨道类型是 ;与SO42-互为等电子体的一种微粒是 。
(3) 胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4
·H2O,其结构示意图如下:
胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4
·H2O,其结构示意图如下:

①胆矾中含有的粒子间作用力是 (填序号)。
a. 离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
②在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1molCN-中 键的数目为
。
键的数目为
。
③胆矾受热分解得到铜的某种氧化物,其晶胞结构如图所示,则氧的配位数是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com