
题目列表(包括答案和解析)
(1)W、X、Y、Z四种元素的名称分别是:W:______,X:______,Y:______,Z:______。
(2)写出Z与W、Y与X所形成的化合物的电子式:_____________________________。
(3)由W、X、Z所形成的离子化合物是_____,它与NaOH溶液反应的离子方程式是_______。
X、Y、Z、W、R为前四周期原子序数依次增大的五种元素,X、Y、Z、W为同一周期相邻元素,Z元素原子核外电子的运动状态共有8种;R元素与比它核电荷数大的另外两种元素位于第四周期同一族。
(1)X的一种核素用于鉴定文物年代,该核素的符号为____。
(2)X、Y、Z、W四种元素第一电离能由大到小的顺序为____(用元素符号表示)。
(3)用氢键表示式写出W的气态氢化物水溶液中不同种分子间存在的氢键____。
(4)Y的一种氢化物分子中共有18个电子,该分子中存在的共价键类型有____(填选项字母)。
A.非极性键;B.极性键;C. 键;D.
键;D. 键;E.p—p
键;E.p—p 键;F.
键;F. 键;G.
键;G. 键;H.
键;H.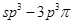 键
键
(5)R的基态原子的价层电子排布式为____,R元素位于周期表的____区。
(6)R单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如下图所示:

图A中原子堆积方式为 ,A、B中R原子的配位数之比为____。A、B晶胞的棱长分别为a cm和b cm,则A、B两种晶体的密度之比为____。
U、V、W、X、Y、Z属于周期表中前18号元素,原子序数依次增大。已知:
①WU4++XU-=WU3 + U2X,各种反应物和生成物的电子总数都与Y+相等;
②Z的单质在X2中燃烧的产物可使品红溶液褪色;
③V的单质在X2中燃烧可生成VX和VX2两种气体;
④Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)WU3分子的空间构型为 Z元素在周期表中的位置是 。
(2)写出Y2X2与水反应的化学方程式: 。
(3)V、W、X形成的10电子氢化物中,沸点最高的是(写化学式) 。
(4)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,反应的离子方程式为
。
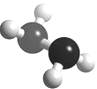
(5)已知下图的球棍模型所表示的是由U、W两种元素组成的共价化合物A, 则A的分子式为 A与氧气及氢氧化钾溶液还可构成燃料电池。正极的电极反应为:
U、V、W、X、Y、Z属于周期表中前18号元素,原子序数依次增大。已知:
①WU4++XU-=WU3 + U2X,各种反应物和生成物的电子总数都与Y+相等;②Z的单质在X2中燃烧的产物可使品红溶液褪色;③V的单质在X2中燃烧可生成VX和VX2两种气体;Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)W的单质分子的结构式为 ;Y2X2的电子式为 ;
Z元素在周期表中的位置是 。
(2)写出Y2X2与水反应的化学方程式: 。
(3)V、W、X形成的10电子氢化物中,沸点最高的是(写化学式) 。
(4)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,反应的离子方程式为
。
(5)由U、V、W、X四种元素组成的离子化合物A,其原子个数比为7:2:1:2,则A为 (写名称),A的水溶液的pH约等于7,其原因是
。

| (b+d) |
| 2 |
| (c+e) |
| 2 |

| ||
| △ |
| ||
| △ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com