
题目列表(包括答案和解析)
下列有关溶液性质的叙述,正确的是
A、室温时饱和的二氧化碳水溶液,冷却到00C时,会放出CO2气体。
B、200C,100g水可溶解34.2gKCl,此时KCl的饱和溶液的质量分数为34.2%
C、强电解质在水中溶解度一定大于弱电解质
D、相同温度下,把水面上的空气换成相同压强的纯氧,100g水中溶入氧气的质量增加
X、Y、Z、W均为含有10电子的微粒,W为金属阳离子,X、Y、Z常温下为气体,
(1)已知: W + X + H2O → 白色沉淀。
①若实验室用下图所示装置、干燥和收集装置制取并收集干燥的X,A中分液漏斗中的液态试剂的仪器的名称是________,仪器的连接顺序为a→________________________;
②由W离子形成的可溶性盐WCln,其水溶液显_________性,原因是(用离子方程式表示)_____________________________________________________
③为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中,_____________________________________________________
(2)常温下,取10 mLpH= a的Y的稀溶液,加水稀释时pH随溶液体积V的变化如图所示,则①Y的化学式为__________。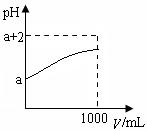
②下列有关Y的叙述正确的是__________
| A.Y溶于水后部分发生电离 |
| B.Y的水溶液中滴加石蕊试液会变红 |
| C.稀释后溶液中所有离子的浓度均减小 |
| D.稀释后,阴离子的物质的量浓度之和不变 |
清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH,Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。
回答下列问题
(1)能否用玻璃试剂瓶来盛HF溶液,为什么?用化学方程式加以解释 ;
(2)写出晶片制绒反应的离子方程式 ,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为 。
(3)本校化学兴趣小组同学,为验证Seidel的理论是否正确,完成以下实验:
|
|
实验事实 |
|
事实一 |
水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气。 |
|
事实二 |
盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用。 |
|
事实三 |
普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解。 |
|
事实四 |
在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2。 |
|
事实五 |
1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL)。 |
结论:从实验上说明碱性水溶液条件下,H2O可作 剂;NaOH作 剂,降低反应 。高温无水环境下,NaOH作 剂。
(4)在太阳能电池表面沉积深蓝色减反膜——氮化硅晶膜。常用硅烷(SiH4)与氨气(NH3)在等离子体中反应。硅烷是一种无色、有毒气体,常温下与空气和水剧烈反应。下列关于硅烷、氮化硅的叙述不正确的是 。
A.在使用硅烷时要注意隔离空气和水,SiH4能与水发生氧化还原反应生成H2;
B.硅烷与氨气反应的化学方程式为:3SiH4+4NH3=Si3N4+12H2↑,反应中NH3作氧化剂;
C.它们具有卓越的抗氧化、绝缘性能和隔绝性能,化学稳定性很好,不与任何酸、碱反应;
D.氮化硅晶体中只存在共价键,Si3N4是优良的新型无机非金属材料。
清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH,Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。
回答下列问题
(1)能否用玻璃试剂瓶来盛HF溶液,为什么?用化学方程式加以解释 ;
(2)写出晶片制绒反应的离子方程式 ,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为 。
(3)本校化学兴趣小组同学,为验证Seidel的理论是否正确,完成以下实验:
| | 实验事实 |
| 事实一 | 水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气。 |
| 事实二 | 盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用。 |
| 事实三 | 普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解。 |
| 事实四 | 在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2。 |
| 事实五 | 1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL)。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com