
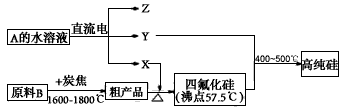
题目列表(包括答案和解析)
A.+184.6 kJ·mol-1 B.-92.3 kJ·mol-1
C.+92.3 kJ·mol D.-369.2 kJ·mol-1
A.+184.6 kJ·mol-1
B.-92.3 kJ·mol-1
C.-369.2 kJ·mol-1
D.+92.3 kJ·mol-1
Cl2(g)+H2(g)![]() 2HCl(g) ΔH=-184.6 kJ·mol-1,则反应HCl(g)
2HCl(g) ΔH=-184.6 kJ·mol-1,则反应HCl(g)![]()
![]() H2(g)+
H2(g)+![]() Cl2(g)的ΔH为( )
Cl2(g)的ΔH为( )
A.+184.6 kJ·mol-1 B.-92.3 kJ·mol-1
C.-369.2 kJ·mol-1 D.+92.3 kJ·mol-1
已知H2 (g)+Cl2 (g)=2HCl (g);△H=-184.6 kJ · mol-1,则反应
HCl (g) =![]() H2 (g) +
H2 (g) + ![]() Cl2 (g) 的△H为
Cl2 (g) 的△H为
A. +184.6 kJ · mol-1 B. -92.3 kJ · mol-1
C. -369.2 kJ · mol-1 D. +92.3 kJ · mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com