
题目列表(包括答案和解析)
(9分)原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满。下表是主要化合价及原子半径数据:
|
|
A |
B |
C |
D |
E |
F |
|
主要化合价 |
-1 |
-3 +5 |
-2 +6 |
-1 +7 |
+2 |
+1 +2 |
|
原子半径 |
0.071 |
0.11 |
0.102 |
0.099 |
0.197 |
0.117 |
(1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(2)B的氢化物中心原子采取 杂化,空间构型是 形,是 分子(填“极性”或“非极性”);
(3)F2+与NH3 形成配离子的结构式为 ;往某种蓝色溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,可得到含有上述配离子的配合物。写出沉淀溶解的离子方程式 。
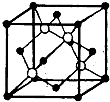
(4)A 、E两种元素形成晶体晶胞是下图中的 (填①、②、③或④);

① ② ③ ④
(5)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出C的氢化物所在的折线 (填n、m、x或y)。

| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |

 (2013?临沂一模)【化学--物质结构与性质】
(2013?临沂一模)【化学--物质结构与性质】| 160 |
| a3b |
| 160 |
| a3b |
 (2013?聊城一模)【化学--物质结构与性质】
(2013?聊城一模)【化学--物质结构与性质】

| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com