
题目列表(包括答案和解析)
X、Y、Z、L、M、N是六种原子序数依次增大的前四周期元素。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。N的核电荷数比L的核电荷数的3倍多2, 回答下列问题:
(1)X和Y可以形成10电子、14电子、18电子分子,写出X元素质子数和中子数相等的核素的符号 。由X和Y元素组成的14电子分子的电子式为 。
(2)在水溶液中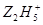 将Fe3+还原为Fe2+,
将Fe3+还原为Fe2+,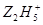 +4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
+4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
(3)一定条件下,M与TiO2、C(石墨)反应只生成M的氧化物和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知。该反应生成lmol M的氧化物时放出536kJ的热量,其热化学方程式为 。
(4)Z元素的气态氢化物和最高价氧化物对应的水化物化合生成一种盐,该盐的水溶液呈 (填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序 。
(5)N的低价硫酸盐溶液与过氧化钠反应。若N的低价硫酸盐与过氧化钠的物质的量之比为2:1,且无气体生成,则该反应的离子方程式为 。
(13分)根据所学知识填空
(1)第二周期第VIA族的元素是第几号元素?
(2)核电荷数为13的元素在周期表中的位置第 周期第 族
(3)原子核内有10个质子的原子
(4)核外有10个电子的+2价阳离子
(5)核内有18个电子的一1价阴离子
(6)L层为最外层,L层的电子数是K层的3倍的原子 。
下面几题用“>”或“<”回答下列问题:
(7)酸性:H2CO3 H2SiO3 , H2SiO3 H3PO4
(8)碱性:Ca(OH)2 Mg(OH)2 ,Mg(OH)2 Al(OH)3.
(9)气态氢化物稳定性:H2O H2S , H2S HCl 。
(11分) A、B、C、D、E、F六种元素,它们的核电荷数均小于18,且原子序数逐渐增大。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。11.5g A单质恰好与100mL 5mol/L的盐酸完全反应,反应后溶液呈中性。D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。请回答下列问题:
(1)D的元素符号 ,E的最高价氧化物的水化物的分子式 。
(2)画出B元素的原子结构示意图 。
(3)若构成F元素的一种原子的质量数为35,写出其原子符号 ,它原子核内的中子数是 。
(4)A与F、C与F、A与C元素最高价氧化物的水化物反应的离子方程式依次
为: 、 、 。
A.核电荷数为13的元素
B.质量数为35、中子数为18的元素
C.质量数为24、中子数为12的元素
D.M层比L层电子数少6个电子的元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com