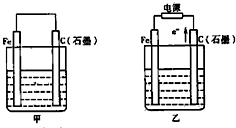
如图甲、乙是电化学实验装置.
(1)若甲、乙两烧杯中均盛有NaCl溶液.
①甲中石墨棒上的电极反应式为
2H2O+O2+4e-═4OH-
2H2O+O2+4e-═4OH-
;
②乙中总反应的离子方程式为
;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl
2氧化了生成的I
2.若反应中Cl
2和I
2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为
5Cl2+I2+6H2O═10HCl+2HIO3
5Cl2+I2+6H2O═10HCl+2HIO3
.
(2)若甲、乙两烧杯中均盛有CuSO
4溶液.
①甲中铁棒上的电极反应式为
Fe-2e-═Fe2+
Fe-2e-═Fe2+
;
②乙中Fe电极是
阴极
阴极
(填阳极或阴极),总反应式是
2CuSO
4+2H
2O
2Cu+O
2↑+2H
2SO
42CuSO
4+2H
2O
2Cu+O
2↑+2H
2SO
4,电解一段时间后溶液PH将
减小
减小
(填增大、减小或不变)

 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.