
题目列表(包括答案和解析)
(共12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)Z原子的核外电子排布为 ;
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式: ;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,其离子方程式为 。
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。写出加热条件下乙与过量NaOH溶液反应的离子方程式 。
(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为 。该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为 L。
(12分) 恒容密闭容器中,某化学反应2A  B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
实验序号 |
浓度(mol/L) |
时间(min) |
|||||||
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|||
|
1 |
温 度 |
8000C |
1.0 |
0.80 |
O.64 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
8000C |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
|
3 |
8000C |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
|
4 |
8200C |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在前20min内用B的浓度变化来表示的平均速率
为 mol/(L·min)。
(2)在实验2,A的初始浓度c2= mol/L,反应在 20分钟内就达到
平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1(用同种物质的浓度变
化表示),则达到平衡时υ3 υ1(填>、=、<=)
且c3 = mol/L。
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热”、“放热”)。
(5) 800℃时,反应2A  B+D的平衡常数=
,
B+D的平衡常数=
,
实验2中达到平衡时A的转化率= 。
(12分) 恒容密闭容器中,某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 | 浓度(mol/L) | 时间(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 温 度 | 8000C | 1.0 | 0.80 | O.64 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 8000C | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 8000C | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 8200C | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在前20min内用B的浓度变化来表示的平均速率
为 mol/(L·min)。
(2)在实验2,A的初始浓度c2= mol/L,反应在 20分钟内就达到
平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1(用同种物质的浓度变
化表示),则达到平衡时υ3 υ1(填>、=、<=)
且c3 = mol/L。
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热”、“放热”)。
(5) 800℃时,反应2A B+D的平衡常数= ,
实验2中达到平衡时A的转化率= 。
(12分)透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:
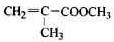
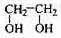
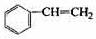

(甲) (乙) (丙) (丁)
填写下列空白:
(1)下列试剂能与甲反应而褪色的是___________(填标号)
a. Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:_______
(3)淀粉通过下列转化可以得到乙(其中A—D均为有机物):
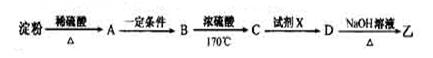
A的分子式是___________,试剂X可以是___________。
(4)已知: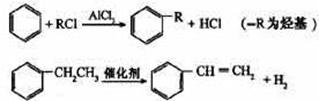
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 。
(12分)现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制500 mL、0.2 mol·L-1的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④托盘天平 ⑤量筒 ⑥药匙
请完成下列问题:
(1)上述仪器中,在配制稀硫酸时用不到的有________(填代号),
除上述仪器外,还缺少的必要仪器是
(2)经计算,需浓硫酸的体积为________,现有①10 mL ②25 mL ③50 mL ④100 mL四种规格的量筒,你选用的量筒是________(填代号)。
(3)在配制过程中,其他操作都准确,下列操作中错误的是_____ ___________,能引起误差偏高的有_____ ___(填代号)。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中 ③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸 ④定容时,加蒸馏水超过标线,又用胶头滴管吸出 ⑤转移前,容量瓶中含有少量蒸馏水 ⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线 ⑦定容时,俯视标线
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com