
题目列表(包括答案和解析)
判断:
⑴溶液中含有 粒子。
⑵溶液中有两种粒子的物质的量之和一定等于0.010 mol,它们是 和 。
⑶溶液中n(CH3COO-)+n(OH-)-n(H+)= mol。
常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合液。
判断:
⑴溶液中含有 粒子。
⑵溶液中有两种粒子的物质的量之和一定等于0.010 mol,它们是 和 。
⑶溶液中n(CH3COO-)+n(OH-)-n(H+)= mol。
如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡。试回答:
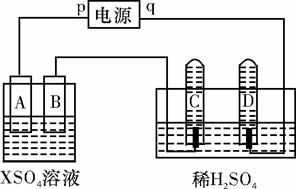
(1)p为 极,A极发生了 反应。
(2)C为 极,试管里收集到的气体是 。
(3)C极的电极反应式是 。
(4)在电解过程中,测得的C、D两极上产生的气体的实验数据如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体体积 (cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成气体体积 (cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,造成阴、阳两极气体体积比变化的可能原因
是 。
(5)当反应进行一段时间后,A、B电极所在的电解池中溶液的pH (填“增大”、“减小”或“不变”)。
(6)当电路中通过0.004 mol电子时,B电极上沉积金属X为0.128 g,则此金属的摩尔质量为 。
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:

① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。 请回答:
(1)以上步骤有错误的是(填编号)_____,该错误操作会导致测定结果
(填“偏大”、“偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟不变色。
(4)图19是某次滴定时的滴定管中的液面,其读数为 mL
(5)根据下列数据:请计算待测盐酸溶液的浓度: mol/L
滴定次数 | 待测液体积(mL) | 标准烧碱体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
向20mL 0.1mol•L-1的Ba(OH)2溶液中通入CO2气体,当得到0.0015mol沉淀时,通入CO2的物质的量是( )
A.0.0015 mol B.0.002 mol C.0.0025 mol D.0.004 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com