
题目列表(包括答案和解析)
| ||
| ||
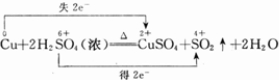
 CuSO4+SO2↑+2H2O反应中
CuSO4+SO2↑+2H2O反应中 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O(1)在Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O反应中,若有3.2 g的Cu参与反应,则被还原的H2SO4的物质的量是________mol.
CuSO4+SO2↑+2H2O反应中,若有3.2 g的Cu参与反应,则被还原的H2SO4的物质的量是________mol.
(2)下图是我校化学实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.计算:(要求写出简要计算过程)

①求该浓硫酸的物质的量浓度?
②用该浓硫酸配制200 mL 1 mol/L的稀硫酸,量筒所需量取该浓硫酸的体积是多少mL?
| ||

| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com