盐酸、硝酸都是用途相当广泛的两种酸.
(1)瑞典科家舍勒在研究软锰矿(主要成份为MnO
2)时,将浓盐酸与软锰矿混合加热,产生了一种有刺激性气味的有色气体.写出该反应的化学方程式,并标出电子转移方向和数目:
.
(2)某校合作学习探究小组学习科学家探究精神对氯气性质进行了探究,设计了以下一些实验.
|
实验内容 |
实验现象 |
| A |
收集一集气瓶气体,观察颜色,然后向瓶内倒入约占瓶容积1/5的蒸馏水,充分振荡. |
蒸馏水呈浅黄绿色,瓶内气体仍呈黄绿色. |
| B |
取出瓶内部分溶液,滴入紫色石蕊试液中直至过量. |
紫色石蕊试液先变红色,后红色褪色. |
| C |
取出瓶内剩下的部分溶液,滴入硝酸银溶液中. |
产生大量白色沉淀 |
| D |
最后向瓶内倒入少量浓氢氧化钠溶液,振荡. |
瓶内黄绿色气体立即消失. |
①能说明氯气与水发生化学反应的实验是
BC
BC
(填实验序号)
②写出实验D中所发生反应的离子方程式
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.
(3)该校另一合作学习探究小组用下列如图1所示装置对铜与硝酸反应进行探究.
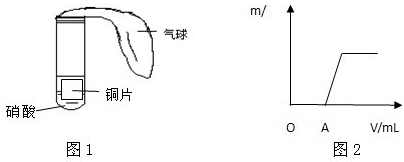
①甲同学观察到试管中的气体由无色变成了红棕色,由此认为试管里的硝酸是浓硝酸,你认为他的看法正确吗?
不正确
不正确
.为什么?
因为一氧化氮与试管内空气中的氧气反应,也会产生红棕色气体,浓硝酸和铜反应生成的是红棕色二氧化氮气体
因为一氧化氮与试管内空气中的氧气反应,也会产生红棕色气体,浓硝酸和铜反应生成的是红棕色二氧化氮气体
.甲同学还能观察到的现象有
气球鼓起胀大,铜片上放出气泡,溶液由无色变成蓝色,铜片变小甚至消失
气球鼓起胀大,铜片上放出气泡,溶液由无色变成蓝色,铜片变小甚至消失
.
②乙同学向反应完成后的溶液里滴加氢氧化钠溶液,产生的沉淀(m/g)和加入溶液的体积(V/mL)的关系如图2所示.请写出O-A段反应的离子方程式
H++OH-=H2O
H++OH-=H2O
.




