
题目列表(包括答案和解析)
下列关于化合价的叙述中,错误的是( )
A、 单质中元素的化合价为零
B、化合物中元素的正负化合价的代数和为零。
C、金属元素在化合物中只显正价
D、非金属元素在化合物中只显负价
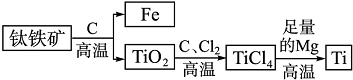 中国有广阔的海域,拥有航空母舰保卫祖国海疆已不再是中国人遥远的梦想.建造航母需要大量的金属钛.钛因其硬度大、熔点高、常温下耐酸碱、耐腐蚀等优良的性能,被誉为“未来金属”.由钛铁矿提取金属钛的主要工艺过程如下:下列有关叙述错误的是( )
中国有广阔的海域,拥有航空母舰保卫祖国海疆已不再是中国人遥远的梦想.建造航母需要大量的金属钛.钛因其硬度大、熔点高、常温下耐酸碱、耐腐蚀等优良的性能,被誉为“未来金属”.由钛铁矿提取金属钛的主要工艺过程如下:下列有关叙述错误的是( )| A、TiCl4在高温下与足量Mg反应生成金属Ti属于置换反应 | B、TiCl4属于化合物,但不是氧化物 | C、上述生产过程中得到的金属钛中混有少量金属杂质,可加适量稀盐酸除去 | D、分离出的铁与制取钛无关,可作为垃圾处理 |
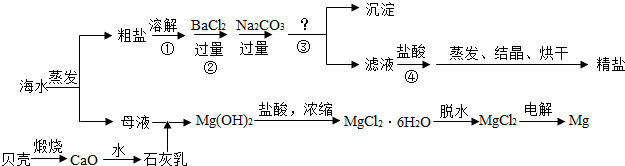


通过海水晾晒可得粗盐和母液,粗盐除NaCl外,还含有CaCl2、Na2SO4以及泥沙等杂质。海水可同时生产氯化钠和金属镁或镁的化合物等产品,其流程如下图所示:
(1)制得粗盐和精盐的操作都包括蒸发步骤,有关其中“蒸发”步骤的叙述错误的是________。
a. 蒸发的目的是得到热饱和溶液 b. 蒸发的目的是析出晶体
c. 应用余热蒸干溶液 d. 应蒸发至有较多晶体析出时为止
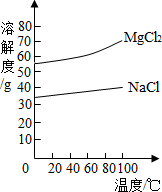
(2)由MgCl2溶液得到MgCl2·6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是_________。(填写“得到热饱和溶液”或“析出晶体”)
(3)在第①步粗盐溶解操作中要用玻璃棒搅拌,其作用是 ;第②步加试剂的目的是除去粗盐中的 (填化
学式),第④步加入盐酸的目的是 。
(4)该流程的副产品中,除钙元素能被海洋生物利用外,还需综合利用的物质是_________。
(5)MgCl2可电解制Mg,MgO则是重要的耐火材料。在550℃时,MgCl2·6H2O会分解生成MgO、MgCl2、HCl和水,其中MgO、MgCl2的物质的量
之比为3:1,该反应的化学方程式为
;若不补充其它原料,还可制得溶质质量分数为_______%的盐酸。(计算结果精确到0.1)
(6)电解食盐水所得溶液中的溶质主要为氢氧化钠和氯化钠(其它溶质可忽略不计),已测得该溶液的密度为1.2 g/mL,为进一步测定其中氢氧化钠的含量,取该溶液样品25 mL与10%的稀硫酸反应,当加入49g稀硫酸时恰好完全中和。请根据化学方程式列式计算:
①25 mL该溶液样品中含氢氧化钠多少克?
②该溶液样品中氢氧化钠的质量分数是多少?

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com