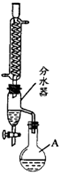
(2012?江苏三模)乙酸正丁酯是常用的食用香精.实验室用正丁醇和乙酸制备乙酸正丁酯的装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:
步骤1:制备乙酸正丁酯.在干燥的50mL的A中,加入11.5mL正丁醇和7.2mL冰醋酸,再加入3~4滴浓硫酸.振荡混合均匀后加入1~2粒B;然后安装分水器及回流冷凝管,并在分水器中加水至略低于支管口.加热回流,通过开关控制分水器中水层液面在原来高度.反应完毕,停止加热.
步骤2:产品提纯.将分水器中的酯层和A中的反应液合并,依次用10mL水、10mL 10% Na
2CO
3溶液、10mL水、10mL水洗涤.洗涤干净后加入少量硫酸镁干燥,干燥后蒸馏收集124~126℃馏分,得产品.
(1)仪器A的名称是
圆底烧瓶
圆底烧瓶
;加入的B是
沸石
沸石
(填名称).
(2)该实验中,使用分水器的目的是
及时分离出产物水,使化学平衡向生成物的方向移动,提高酯的产率
及时分离出产物水,使化学平衡向生成物的方向移动,提高酯的产率
.
(3)步骤1中判断反应结束的现象是
分水器中水层液面高度不再变化
分水器中水层液面高度不再变化
.
(4)步骤2中从分液漏斗中得到酯的操作是
打开分液漏斗活塞.让水层从分液漏斗下口流出,酯层从上口倒出
打开分液漏斗活塞.让水层从分液漏斗下口流出,酯层从上口倒出
;用10% Na
2CO
3溶液洗涤时发生的主要反应的离子方程式为
2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O
2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O
.

 的物质计量数;X1、X2表示不同温度或压强),某物理量Y随时间(t)变化的情况如图所示,
的物质计量数;X1、X2表示不同温度或压强),某物理量Y随时间(t)变化的情况如图所示,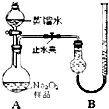 (2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.
(2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究. a
a
 (2012?江苏三模)乙酸正丁酯是常用的食用香精.实验室用正丁醇和乙酸制备乙酸正丁酯的装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:
(2012?江苏三模)乙酸正丁酯是常用的食用香精.实验室用正丁醇和乙酸制备乙酸正丁酯的装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下: