(2009?南京二模)某种胃药中止酸剂为CaCO
3.为测定其中CaCO
3含量,某研究小组设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答有关问题:

(1)方案一:用如图1装置测量一定量样品与足量稀盐酸反应生成CO
2的体积,计算CaCO
3的含量;装置中连通管X的作用是
使广口瓶与分液漏斗内气体压强相同,便于滴入酸液
使广口瓶与分液漏斗内气体压强相同,便于滴入酸液
、
消除滴入盐酸体积对所测气体体积的影响
消除滴入盐酸体积对所测气体体积的影响
.
(2)方案二:用滴定法测定,有以下几步操作:
A.配制0.100mol/L HCl溶液和0.100mol/L NaOH溶液
B.取一粒药片(0.100g),研碎后加入20.0mL蒸馏水
C.以酚酞为指示剂,用0.100mol/L NaOH溶液滴定,用去体积为VmL达到终点
D.用酸式滴定管加入25.00mL 0.100mol/L HCl溶液,充分反应
①测定过程的正确操作顺序为
ABDC 或BADC
ABDC 或BADC
(填字母).
②现需要重复滴定4次,配制0.1mol/L HCl溶液需要选用图2所示仪器中的
CD或CDE
CD或CDE
(填字母).
③经测定,每次消耗NaOH溶液体积的平均值为13.00mL,则该胃药中CaCO
3的质量分数
60%
60%
.
④与方案一相比,方案二的主要优点是
滴定法所需样品和试剂量少,实验测定结果误差小
滴定法所需样品和试剂量少,实验测定结果误差小
.


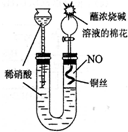 (2009?南京二模)某同学对Cu与HNO3的反应进行如下探究.请回答有关问题.
(2009?南京二模)某同学对Cu与HNO3的反应进行如下探究.请回答有关问题.