
题目列表(包括答案和解析)
(2009东北三校联合一模,8)用Pt电极电解含有各0.1 mol Cu2+和X3+(X只有1种正价态)的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系如图所示,则离子的氧化能力由大到小排列正确的是( )
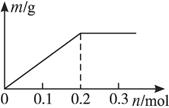
A.Cu2+>X3+>H+ B.H+>X3+>Cu2+
C.X3+>H+>Cu2+ D.Cu2+>H+>X3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com