
题目列表(包括答案和解析)
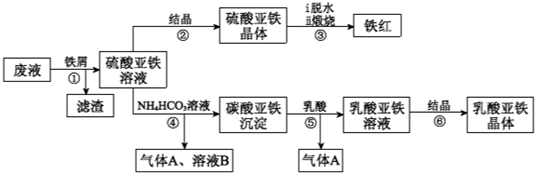
| 13.9 |
| a |
| 13.9 |
| a |
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)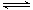 TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某温度反应(Ⅰ)的K=4,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
(2)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,则该正反应的△H 0(填“>”或“<”),上述反应体系中循环使用的物质是 。
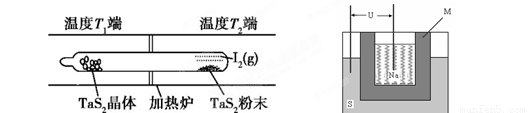
(3)上图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na + xS=Na2Sx,正极的电极反应式为____________________________。M(由Na2O和Al2O3制得)的两个作用是________________________________________________和隔离钠与硫。
(4)写出Na2S溶液水解的离子方程式_______________________________________ ,Na2S溶液中c(H+)+ c(Na+)=________________。
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某温度反应(Ⅰ)的K=4,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
(2)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,则该正反应的△H 0(填“>”或“<”),上述反应体系中循环使用的物质是 。
(3)上图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na + xS=Na2Sx,正极的电极反应式为____________________________。M(由Na2O和Al2O3制得)的两个作用是________________________________________________和隔离钠与硫。
(4)写出Na2S溶液水解的离子方程式_______________________________________,Na2S溶液中c(H+)+ c(Na+)=________________。
NH3+CO2+NaCl+H2O====NH4Cl+NaHCO3(晶体)
依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:

(1)A装置中所发生反应的离子方程式为_____________,C装置中稀硫酸的作用为_________________________。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/l00g水)
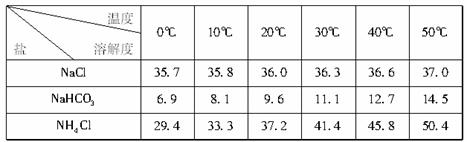
参照表中数据,请分析B装置中使用冰水是因为__________________________________。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在_____________装置之间(填写字母)连接一个盛有____________的洗气装置,其作用是_________________________________________________________________.
(4)利用改进后的装置进行实验,在B中的试管中析出了晶体,经必要的操作后得到了一种纯净的晶体。现有下列试剂:盐酸、浓氨水、生石灰、蒸馏水,利用本题所提供的试剂(只限一种)及试管、酒精灯等主要仪器,通过简单实验判断该晶体是碳酸氢钠晶体,而不是碳酸氢铵或食盐晶体,简述操作方法、实验现象及结论:_________________________________________。
(5)若该校学生进行实验时,所用饱和食盐中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为_____________。
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O NH4Cl+NaHCO3(晶体)依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
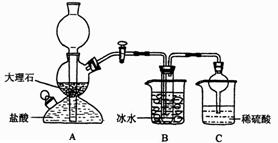
(1)A装置中所发生反应的离子方程式为 。
C装置中稀硫酸的作用为 。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)

参照表中数据,请分析B装置中使用冰水是因为 。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用是 。
(4)利用改进后的装置进行实验,在B中的试管内析出了晶体,经必要的操作后得到了一种纯净的晶体。现有下列试剂:盐酸、浓氨水、生石灰、蒸馏水,利用本题所提供的试剂(只限一种)及试管、酒精灯等主要仪器,通过简单实验判断该晶体是碳酸氢钠晶体,而不是碳酸氢铵或食盐晶体,简述操作方法、实验现象及结论:
。
(5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com