
题目列表(包括答案和解析)
 香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:下列说法正确的是( )
香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:下列说法正确的是( )

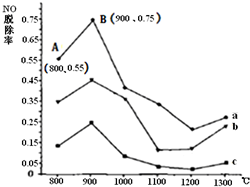 (2013?朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
(2013?朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.(2)在一定条件下进行如下反应:
aX(g)+bY(g)![]() cZ(g)
cZ(g)
下图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系示意图。

①写出该反应的化学平衡常数表达式:K=___________。随着温度的升高,K值___________ (填“增大”“减小”或“不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明__________(填序号)。
A.X的转化率越高 B.反应进行得越完全
C.达到平衡时X的浓度越大 D.化学反应速率越快
②如下图所示,相同温度下,在甲、乙两容器中各投入1 mol X、2 mol Y和适量催化剂,甲、乙两容器的初始体积均为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com