
题目列表(包括答案和解析)
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
| 1 |
| 2 |
下列热化学方程式书写正确的是(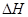 的绝对值均正确)
的绝对值均正确)
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H= —1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H= + 57.3kJ/mol(中和热)
C.P(s)+ 3/2 Cl2(g)=== PCl3(g);△H= —306 kJ/mol(反应热)
D. 2NO2==O2+2NO;△H= + 116.2kJ/mol(反应热)
火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100℃~1300℃,使锌蒸馏出来(设空气中N2、O2的体积分数分别为0.8、0.20),主要反应为:
焙烧炉中:2ZnS(s) + 3O2(g) → 2ZnO(s) + 2SO2(g) ①
鼓风炉中:2C(s) + O2(g) →2CO ②
鼓风炉中:ZnO(s) + CO(g) Zn(g)+CO2(g)
③
Zn(g)+CO2(g)
③
(1)已知闪锌矿中含硫16%(其它杂质不含硫),则闪锌矿中硫化锌的含量为 。
(2)焙烧炉产生的炉气中SO2的体积分数不超过 %(保留小数后一位数字)。
⑶鼓风炉容积固定,炉内部分气态物质其物质的量浓度(mol/L)变化如下:
|
时间/min |
CO |
Zn |
CO2 |
|
0 |
0.11 |
0 |
0 |
|
2 |
0.10 |
0.01 |
0.01 |
|
3 |
0.01 |
0.10 |
0.10 |
|
4 |
0.01 |
0.10 |
0.10 |
则鼓风炉中CO总的转化率为 ;若生产中CO总的利用率为95%,则每生产1molZn,至少需要补充焦炭 g。
⑷若ZnS全部转化为Zn。焙烧炉出来的N2、O2、SO2混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余,则每生产1mol Zn,应向焙烧炉和鼓风炉中鼓入新鲜空气共 L(S.T.P)。
(11分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca。
(1)Ca的原子结构示意图 。
(2)配平用钙线氧脱鳞的化学方程式:
P + FeO + CaO  Ca3(
Ca3( PO4)2 + Fe
PO4)2 + Fe
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n。则金属M为_________,检测Mn+ 的方法是_____________________(用离子方程式表达)。
(4)取1.6g钙线试样,与水充分反应,生成224ml H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3 g。
(5)处理炼钢厂含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:CO(g) + 1/2 O2(g) ="=" CO2(g)  H = -283.0 kJ·mol-2
H = -283.0 kJ·mol-2
S(s) + O2(g) ="=" YO2(g)
+ O2(g) ="=" YO2(g)  H = -296.0 kJ·mol-1
H = -296.0 kJ·mol-1
此反应的热化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com