
题目列表(包括答案和解析)
某同学在科技活动课上用如图所示的实验装置论证质量守恒定律,瓶内放了足量的盐酸,
b是未充气的气球,里边放了6.5g锌粉,将它套在瓶口(图Ⅰ),将图Ⅰ的装置放在托盘天平上称量,质量为w1g,然后将气球内锌粉全部倒入瓶内,立即产生气体,气球逐渐胀大,锌粉全部反应(图Ⅱ),反应结束后,再次称量,质量为w2g,结果w2g<w1g.试分析: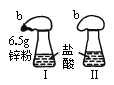
(1)此反应是否符合质量守恒定律?________(填“符合”或“不符合”)
(2)天平显示w2g<w1g的原因是________________________________.
(3)在________条件下称量w2=w1.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com