
题目列表(包括答案和解析)
【物质结构与性质】(8分)
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Cu、Fe、Zn等,其中铜及其合金是人类最早使用的金属材料,用途广泛。
(1)铜原子的核外电子排布式是 ;O、N、S的第一电离能由大到小的顺序为 。
(2)铜的熔点比钙高,其原因是 ;
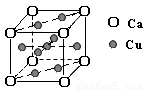
右图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为 。
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。
A.配位键B.金属键C.极性共价键D.非极性共价键E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 (填序号)。
A.平面正方形 B.正四面体 C.三角锥型 D.V型
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:
HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 。
【物质结构与性质】(8分)
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Cu、Fe、Zn等,其中铜及其合金是人类最早使用的金属材料,用途广泛。
(1)铜原子的核外电子排布式是 ;O、N、S的第一电离能由大到小的顺序为 。
(2)铜的熔点比钙高,其原因是 ;
右图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为 。
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。
A.配位键B.金属键C.极性共价键D.非极性共价键E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 (填序号)。
A.平面正方形 B.正四面体 C.三角锥型 D.V型
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:
HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 。
2- 4 |
2- 4 |
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Cu、Fe、Zn等,其中铜及其合金是人类最早使用的金属材料,用途广泛.
(1)铜原子的核外电子排布式是________;O、N、S的第一电离能由大到小的顺序为________.
(2)铜的熔点比钙高,其原因是________;下图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为________.

(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物.
①[Cu(NH3)4]2+中存在的化学键类型有________(填序号).
A.配位键
B.金属键
C.极性共价键
D.非极性共价键
E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________(填序号).
A.平面正方形
B.正四面体
C.三角锥型
D.V型
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:
HOCH2CH=CH2→CH3CH2CHO.在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为________.
【化学——选修3:物质结构与性质】(15分)
在A、B、C三种元素中,A元素原子的价电子排布为2s22p5,B元素K、L能层上的电子数与M、N层上的电子数相同。C元素的原子序数等于A、B两元素原子序数之和,C的单质在生产生活中具有许多用途,它可在硫酸铜溶液中用电解法进行精炼。请回答以下问题:
(1)已知C元素的电负性数值为1.9,则A、C两元素的原子之间应形成 键(填“共价”或“离子”);
(2)C元素的价电子排布式为____;
(3)在A元素氢化物的水溶液中,存在有 种不同类型的氢键;
(4)SO42—中S原子的杂化轨道类型是____,SO42—的立体构型是____;
(5)一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(6)在A、B两元素所形成晶体的晶胞中,位于六面体顶点和面心上的元素为 (填具体的元素符号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com