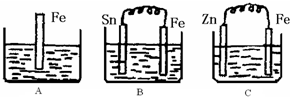
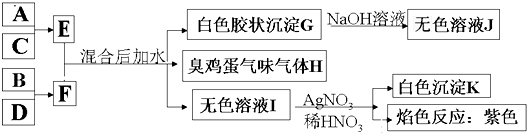
A、B、C、D、E五种溶液分别是NaOH、NH
3?H
2O、CH
3COOH、HCl、NH
4HSO
4中的一种.常温下进行下列实验:
①将1L pH=3的A溶液分别与0.001mol/L x L B溶液、0.001mol/L y L D溶液充分反应至中性,x、y的大小关系式y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C和D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)C是
NH4HSO4
NH4HSO4
溶液,D是
NaOH
NaOH
溶液.
(2)用水稀释0.1mol/L B溶液时,溶液中随水量的增加而减小的是
AB
AB
.
A.
B.
C.c (H
+)?c (OH
-) D.n (OH
-)
(3)等pH、等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同.则
HCl
HCl
(填化学式)溶液中锌粉有剩余.
(4)常温下,向0.01mol/L C溶液中滴加0.01mol/L D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为
c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)
c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)
.
(5)已知常温下Mg(OH)
2在pH=12的D溶液中Mg
2+的浓度为1.8×10
-7mol/L,则 Ksp[Mg(OH)
2]=
1.8×10-11(mol/L)3
1.8×10-11(mol/L)3
.





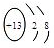
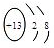


 2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=
2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=