
题目列表(包括答案和解析)

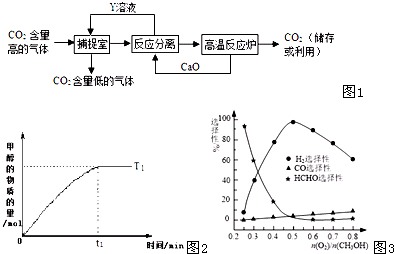
| 催化剂 |
| △ |
| 催化剂 |
| △ |

| 物质 | 甲醇 | 汽油(C8H8) | 一氧化碳 |
| 燃烧热/kJ?mol-l | 725 | 5518 | 283 |
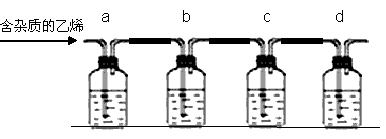
为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:在圆底烧瓶中加入适量的乙醇与浓硫酸的混合物,加热到170℃时生成乙烯.甲同学将生成的气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.乙同学发现甲同学实验中,圆底烧瓶中液体变黑,尾气夹杂有刺激性气味的气体,推测在制得的乙烯中还有可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应.请回答问题:
(1)甲同学设计的实验不能验证乙烯与溴发生加成反应,其理由是________;
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙烯
d.使溴水褪色的物质,就是乙烯
(2)乙同学推测此乙烯气中可能含有一种杂质气体是________,验证过程中必须全部除去,于是设计了如下流程装置图用以证明自己的杂质猜想并验证乙烯与溴水的加成反应,写出装置内所放化学药品.

已知b瓶盛放氢氧化钠溶液,d瓶盛放溴水,而ac瓶盛放的化学药品相同,那么应该是________溶液.
写出有关方程式①乙烯与溴水反应________;②该杂质与溴水反应________.
(3)1928年德国化学家第尔斯和他的学生阿尔德首次发现和记载一种新型反应,他们因此获得1950年的诺贝尔化学奖,该反应被命名为第尔斯-阿尔德反应,简称DA反应.该反应是一种环加成反应,凡含有双键或三键的不饱和化合物,可以和链状或环状含共轭双烯体系发生1,4加成反应,通常生成一个六元环,该反应条件温和,产率很高,是有机化学合成反应中非常重要的碳碳键形成的手段之一,也是现代有机合成里常用的反应之一.乙烯与1,3-丁二烯(共轭双烯体系的代表物)在一定条件下能够发生DA反应,得到环己烯.请用键线式书写该方程式________.写出环己烯的一种链状的同分异构体的结构简式________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com