
题目列表(包括答案和解析)
N和B元素在化学中有很重要的地位。k.s.5.u
(1)写出与N元素同主族的As元素的基态原子核外电子排布式_____________________。
从原子结构的角度分析B、N和O元素的第一电离能由大到小的顺序为____________。
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其原因是_____________________________________________,其中BF3的分子构型为__________。
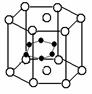 (3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(4)硼和镁的化合物在超导方面也有应用。右图示意的是该化合物的晶体结构单元;镁原子间形成正六棱柱,且棱柱的上下底的中心各有一个镁原子;六个硼原子位于棱柱内,则该化合物的化学式可表示为______________。
N和B元素在化学中有很重要的地位。k.s.5.u
(1)写出与N元素同主族的As元素的基态原子核外电子排布式_____________________。
从原子结构的角度分析B、N和O元素的第一电离能由大到小的顺序为____________。
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其原因是_____________________________________________,其中BF3的分子构型为__________。
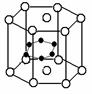 (3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(4)硼和镁的化合物在超导方面也有应用。右图示意的是该化合物的晶体结构单元;镁原子间形成正六棱柱,且棱柱的上下底的中心各有一个镁原子;六个硼原子位于棱柱内,则该化合物的化学式可表示为______________。

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 12.4 |

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 12.4 |
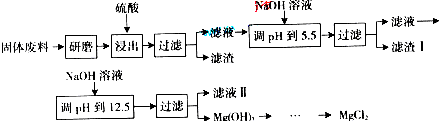
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com