
题目列表(包括答案和解析)
碱存在下,卤代烃与醇反应生成醚(R-O-R');(其中R、R'为烃基)
![]() 化合物A经下列四步反应可得到常用溶剂四氢呋喃,反应框图如下;
化合物A经下列四步反应可得到常用溶剂四氢呋喃,反应框图如下;
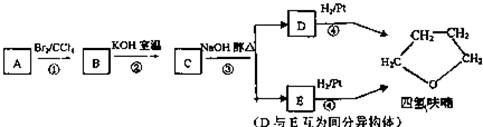
请回答下列问题:
(1)1mol A和1 molH2在一定条件下恰好反应,生成饱和一元醇Y,Y中碳元素的质量分数约为65%,则Y的分子式为 。
A分子中所含官能团的名称是 。
A的结构简式为 。
(2)第①②③步反应类型分为① ② ③
(3)化合物B具有的化学性质(填写字母代号)是 。
a.可发生氧化反应 b.强酸或强碱条件下均可发生消去反应
c.可发生酯反应 d.催化条件下可发生如聚反应
(4)写出C、D和E的结构简式:
C 、D和E 。
(5)写出化合物C与NaOH水溶液反应的化学方程式;
(6)写出四氢呋喃链状醚类的所有同分异构体的简式;
Ⅰ Ⅱ Ⅲ Ⅳ
盐酸溶液的体积(mL) 30 30 30 30
样品(g) 3.32 4.15 5.81 7.47
二氧化碳的体积(mL) 672 840 896 672
(1)由第Ⅰ组数据中的CO2体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生CO2________mL(标准状况)。
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式。
(3)已知Na2CO3和HCl(aq)的反应分下列两步进行:
Na2CO3+HCl→NaCl+NaHCO3
NaHCO3+HCl→NaCl+CO2↑+H2O
由上表中第Ⅳ组数据可以确定所用的HCl(aq)的浓度为________mol/L
(4)依据上表所列数据以及天然碱的化学式,讨论并确定上述实验中CO2(标准状况)体积V(mL)与样品质量W(g)之间的关系式。
某天然碱(纯净物)可看做由CO2和NaOH反应后的产物所组成。称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2体积(标准状况)如下表:
Ⅰ Ⅱ Ⅲ Ⅳ
盐酸溶液的体积(mL) 30 30 30 30
样品(g) 3.32 4.15 5.81 7.47
二氧化碳的体积(mL) 672 840 896 672
(1)由第Ⅰ组数据中的CO2体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生CO2________mL(标准状况)。
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式。
(3)已知Na2CO3和HCl(aq)的反应分下列两步进行:
Na2CO3+HCl→NaCl+NaHCO3
NaHCO3+HCl→NaCl+CO2↑+H2O
由上表中第Ⅳ组数据可以确定所用的HCl(aq)的浓度为________mol/L
(4)依据上表所列数据以及天然碱的化学式,讨论并确定上述实验中CO2(标准状况)体积V(mL)与样品质量W(g)之间的关系式。
Ⅰ、北京时间11月1日清晨5时58分07秒,中国“长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g)=2H2O(l) ;ΔH=–571.6kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ;ΔH=–890.3kJ·mol-1
C(S)+O2(g)=CO2(g) ;ΔH=–393.5kJ·mol-1
根据上面的热化学方程式完成下列问题:
⑴通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是 。
⑵根据以上反应,则C(S)+2H2(g)=CH4(g)的焓变ΔH= 。
⑶已知H2O(l)=H2O(g);ΔH=+44.0kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气时的热化学方程式:
。
Ⅱ、据统计,发达国家每年由于金属腐蚀造成的直接损失约占全年国民生产总值的2%~4%,远远超出水灾、火灾、风灾、地震等自然灾害造成损失的总和。因此,了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
⑴分别放在以下装置(都盛有0.1mol·L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是 。
⑵利用下图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于 处。若X为锌,开关K置于M处,该电化学防护法称为 。
(16分)Ⅰ铝粉与某些金属氧化物组成的混合物叫铝热 剂,铝热剂在高温下发生的反应叫铝热反应。如:2Al+
剂,铝热剂在高温下发生的反应叫铝热反应。如:2Al+ Fe2O32Fe+Al2O3,反应发生时放出大量的热。仔细阅读上
Fe2O32Fe+Al2O3,反应发生时放出大量的热。仔细阅读上 述信息回答下列问题:
述信息回答下列问题:
(1)“铝热反应”属于四种基本反应类型中的________________反应。
(2)信息中的“某些”指__(填“比铝活泼的”“比铝不活泼的”或“任意”)。
(3)试写出铝粉与MnO2发生的铝热反应方程式
_____________________________________________________________。
(4)题给的铝热反应可用于野外焊接钢轨,试解释其基本原理________________________________________________________________。
II铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途。
(5)铝制容器不能盛装NaOH溶液的原因(用离子方程式表示)
; (6)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是氢氧化铝,其治疗原理是(用离子方程式表示): ;
(6)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是氢氧化铝,其治疗原理是(用离子方程式表示): ;
碳酸氢钠也常用于治疗胃酸过多,写出反应的离子方程式:
;
(7)为完全沉淀氯化铝溶液中的铝元素,常加入过量的 ,反应的化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com