
题目列表(包括答案和解析)

①向含有酚酞的NaOH溶液中滴加双氧水,溶液由红色褪至无色,主要原因是双氧水的______性。
②将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫红色消褪了,此时双氧水表现出______性。
③久置的油画,白色部位(PbSO4)常会变黑(PbS),用双氧水揩擦后又恢复原貌,有关反应的化学方程式为? 。
(2)过氧化氢(H2O2)常被称为“绿色氧化剂”,它和水都是极弱的电解质,但它比水易电离。
①水电离生成H3O+和OH-叫做水的自偶电离。同水一样,过氧化氢也有极弱的自偶电离,其自偶电离的电离方程式为 。
②由于H2O2显弱酸性,在一定条件下它能同强碱作用,生成正盐或酸式盐,请写出H2O2与Ba(OH)2反应生成正盐的化学方程式: 。
 CH3OH(g);ΔH
CH3OH(g);ΔH 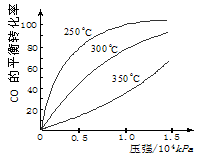
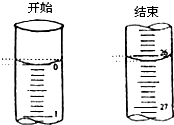 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠 溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com