(2013?济南二模)硫元素的化合物在生产、生活中有着广泛的应用.
(1)400℃,1.01×10
5Pa下,容积为1.0L的密闭容器中充入0.5molSO
2,(g)和0.3molO
2 (g),发生2SO
2(g)+O
2(g)?2SO
3(g)△H=-198kJ?mol
-1反应中n(SO
3)和n(O
2)随时间变化的关系如图1所示.反应的平衡常数K=
160
160
;0到10min内用SO
2:表示的平均反应速率
0.04mol/(L?min)
0.04mol/(L?min)
.更具图1中信息,判断下列叙述中正确的是
AC
AC
(填序号).
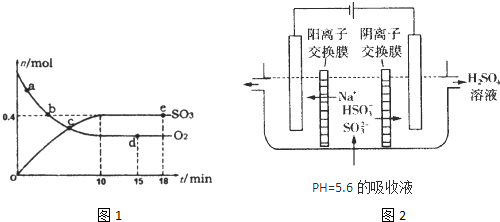
A.a点时刻的正反应速率比b点时刻的大
B.c点时刻反应达到平衡状态
C.d点和e点时刻的c(O
2)相同
D.若500℃,1.01×10
5Pa下,反应达到平衡时,n( SO
3)比图中e点时刻的值大
(2)用NaOH溶液吸收工业废气中的SO
2,当吸收液失去吸收能力时,25℃时测得溶液的pH=5.6,溶液中Na
+,H
+,SHO
3-,SO
32-离子的浓度由大到小的顺序是
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如图2:
HSO3-在阳极室反应的电极反应式为
HSO3-+H2O-2e-=SO42-+3H+
HSO3-+H2O-2e-=SO42-+3H+
.阴极室的产物
H2、NaOH
H2、NaOH
.

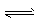 2SO3的反应,并且在10min后达到平衡时,测得容器内有2molSO2和12molO2:
2SO3的反应,并且在10min后达到平衡时,测得容器内有2molSO2和12molO2: 
![]() mY(g)+Z(g),测得平衡混合气体中X的体积分数为58.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g·L-1,则平衡混合气体的平均相对分子质量为( )
mY(g)+Z(g),测得平衡混合气体中X的体积分数为58.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g·L-1,则平衡混合气体的平均相对分子质量为( )