
题目列表(包括答案和解析)
| 信息卡 常温下碳酸钙难溶于水,氢氧化钙微溶于水,氯化钙易溶于水.次氯酸钙易溶于水,酸性条件下不稳定、100°C时发生分解反应. 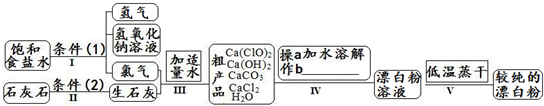 (1)流程I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是 2 2 mol?L-1.(2)写出流程I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:   高温 高温 .(3)流程III中发生两个反应,写出其中的氧化还原反应的化学反应方程 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O .其中氧化剂是Cl2 Cl2 ;还原剂是Cl2 Cl2 .(写化学式)(4)流程IV中操作b是: 过滤 过滤 .(写名称)(5)流程V进行低温蒸干的原因是: Ca(ClO)2在100°C时发生分解反应 Ca(ClO)2在100°C时发生分解反应 .(6)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因 Ca(ClO)2+CO2+H2O═CaCO3+2HClO Ca(ClO)2+CO2+H2O═CaCO3+2HClO .(7)氯水和次氯酸钙都能起漂白、消毒作用.是因为它们都能产生同一种物质,写出氯气与水反应产生该物质的化学方程式 Cl2+H2O  HCl+HClO HCl+HClOCl2+H2O . HCl+HClO HCl+HClO(8)在酸性条件下次氯酸钙的氧化性比氯气强,能将溴离子氧化成溴单质,而次氯酸钙中的氯元素则被还原为负一价的氯离子,氧元素则转化为水.试写出次氯酸钙和稀盐酸的混合物与溴化钠反应的化学方程式: Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O .
我们生活中的许多现象及大量物质的应用都与氧化还原反应有关,请运用氧化还原反应的知识回答下列问题。 (1)氯气跟水反应生成的次氯酸(HClO)具有杀菌作用,常用于自来水的消毒。在次氯酸( HClO)中,氯元素的化合价为 ___,氯原子容易得到电子,从而使氯元素化合价降低,因此次氯酸具有强___。次氯酸具有漂白作用就是基于它的这个性质。 (2)油画所用颜料含有某种白色铅化物,久置于空气中就会变成黑色PbS,从而使油画的色彩变暗。若用 H2O2来“清洗”,则可将PbS转变为白色PbSO4,从而使油画“复原”。 ①上述“清洗”反应的化学方程式为___。 ②在此反应中,H2O2作___剂,发生转移的电子数目为___ 。 传统的自来水处理剂是在自来水中加入规定剂量的液氯,液氯能够溶解于水,并且与水能够发生化学反应。近年来,科技工作者为了延长液氯的杀菌时间,在液氯中加入适量的液氨。 (1)请你写出液氯与水反应的化学方程式:________________________________________________________________________ ________________________________________________________________________, 氧化剂是______,还原剂是______。从氧化剂和还原剂来看,该反应的特点是________________________________________________________________________,
________________________________________________________________________ ________________________________________________________________________。 (2)用液氯作为自来水的杀菌剂,起作用的是HClO,所以液氯加入水中后含氯的物质有氯单质,HClO和 ________________________________________________________________________, 其中氯单质可以从水中挥发,这正是我们有时打开自来水管能够闻到刺激性气味的原因,HClO也可以分解产生氧气和HCl。在液氯中加入少量液氨,生成NH2Cl,NH2Cl比HClO稳定。在HClO浓度大的时候发生的反应是NH3+HClO===H2O+NH2Cl,在HClO浓度小的时候发生的反应是H2O+NH2Cl===NH3↑+HClO,所以这种方法可以缓慢的放出HClO,起杀菌、消毒的作用,减少了氯的流失。以上两个反应的反应类型是________(填序号)。 A.氧化还原反应 B.非氧化还原反应 C.置换反应 D.复分解反应 传统的自来水处理剂是在自来水中加入规定剂量的液氯,液氯能够溶解于水,并且与水能够发生化学反应。近年来,科技工作者为了延长液氯的杀菌时间,在液氯中加入适量的液氨。 (1)请你写出液氯与水反应的化学方程式:____________________,氧化剂是______________,还原剂是 _____________。从氧化剂和还原剂来看,该反应的特点是______________,从元素化合价的变化来看,该反应的特点是______________。 (2)用液氯作为自来水的杀菌剂,起作用的是HClO,所以液氯加入水中后含氯的物质有氯单质、HClO和 ____________,其中氯单质可以从水中挥发,这正是我们有时打开自来水管能够闻到刺激性气味的原因,HClO也可以分解产生氧气和HCl。在液氯中加入少量液氨,生成NH2Cl,NH2Cl比HClO稳定。在HClO浓度大的时候发生的反应是NH3+HClO===H2O+NH2Cl,在HClO浓度小的时候发生的反应是H2O+NH2Cl==NH3↑+HClO,所以这种方法可以缓慢的放出HClO,起杀菌、消毒的作用,减少了氯的流失。以上两个反应的反应类型是________(填序号)。 A.氧化还原反应 B.非氧化还原反应 C.置换反应 D.复分解反应 (2010?海南模拟)食品安全关系国计民生,影响食品安全的因素很多.下面是以食品为主题的相关问题,请根据要求回答. (1)人们从食用植物油中摄取的亚油酸对人体健康是十分有益的,但是市场经常出现价格低廉的劣质植物油,其中亚油酸的含量很低.下列关于亚油酸的说法中,正确的是 AC AC .(提示:亚油酸的结构简式为CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH) A.在食用油中亚油酸通常是以甘油酯的形式存在 B.亚油酸是一种高级饱和脂肪酸 C.亚油酸含量高的食用油在空气中易变质氧化 D.亚油酸与甘油可发生酯化反应,生成的油脂是一种纯净物 (2)酒精在人体肝脏内可转化为多种有害物质,有机物A是其中一种.经分析测得:A的相对分子质量为60,分子中碳氢两元素的质量分数之和为46.4%,其余为氧元素,A的水溶液pH<7.请写出A的结构简式: CH3COOH CH3COOH .(3)聚偏二氯乙烯(  )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由CCl2=CH2 CCl2=CH2 (写结构简式)发生加聚反应生成的.若以CH≡CH为原料,通过加成反应1,1,2-三氯乙烷,再和NaOH溶液反应可合成这种单体.则上述加成反应中宜选择的加成试剂是AB AB .A.HCl B.Cl2 C.HClO D.NaCl. 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |