
题目列表(包括答案和解析)

实验化学:
2005年江苏酸雨污染有所加重,酸雨发生频率为34.1%,上升了6.2个百分点,每三场雨中就有一场多是酸雨.某校研究性学习小组拟对本市空气中二氧化硫含量(mg·m-3)进行测定.经查阅资料可用以下方法测定:
实验原理:大气中的二氧化硫用甲醛溶液吸收后,生成稳定的羟甲基磺酸加成化合物,再加入氢氧化钠使加成化合物分解,释放出二氧化硫与副玫瑰苯胺、甲醛作用,生成紫红色化合物.据其颜色深浅,用分光光度计在577 nm处进行测定.
分光光度计是利用分光光度法对物质进行定量定性分析的仪器.而分光光度法则是通过测定被测物质在特定波长时光的吸收度,对该物质进行定性和定量分析.其工作原理可以简单的用公式表示为A=KC,其中A为吸光度,K为一定条件下的常数,C为溶液浓度.
实验步骤:(1)采样:
①如果你是该兴趣小组成员,你对采样的地点和时间有何建议:
___________________________________
②用如图装置采样,通过50 L空气后,将吸收液移入100 ml容量瓶,用少量吸收液分两次洗涤吸收装置,合并洗涤液于容量瓶中,定容备用.
用多孔球泡而不用导管的原因是____________________________.
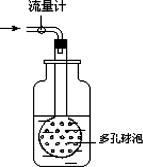
(2)吸光度与SO2含量标准曲线的绘制:在6支25 ml比色管中,用每毫升含25 μg二氧化硫的标准液配置下表标准SO2含量系列.
二氧化硫标准系列

用10 mL比色皿,以水为参比,测定各管吸光度,实验结果如下.

以吸光度值为纵坐标,二氧化硫含量(μg/10 mL)为横坐标,绘制标准曲线
(3)准确量取容量瓶中溶液10 mL加入比色皿,测得其吸光度值为0.10,则空气中二氧化硫含量为________mg·m-3.我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值(mg/m3):一级标准:0.15二级标准:0.50三级标准:0.70.则该市空气为________级标准.
(4)甲、乙两组同学测定结果相差较大,乙组同学测定空气中SO2含量偏小,试分析乙组同学出现误差的可能原因:(两个所用药品和装置均无问题)
_______________________________________
(5)请你提出江苏防治酸雨的两条主要措施:
_______________________________________
(10分)酸雨是指pH<5.6的雨、雪等各种形式的大气降水。二氧化硫是形成酸雨的主要因素之一,它主要是由含硫燃料(煤和石油)燃烧和金属冶炼厂释放的二氧化硫气体造成。酸雨的危害极大,减少二氧化硫等污染物的排放,保护环境是非常重要的。某校化学兴趣小组的学生,分成两组对酸雨及空气中二氧化硫的含量进行了测定。
第一组,取刚降到地面的酸雨水样,进行了如下实验:
(1)将一片红色的玫瑰花瓣浸在一份水样中
(2)向雨水试样中滴加氯化钡溶液,有白色浑浊出现
(3)每隔一定时间测定其pH,数据如表Ⅰ所示。
表Ⅰ 不同时间酸雨的pH
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
(1)一段时间后,观察到红色变浅,可能的原因是 ▲
(2)生成白色浑浊的离子方程式 ▲
(3)分析上述pH数据变化,你认为可能的原因是(用化学方程式表示) ▲
(4)如果取该雨水和蒸馏水混合,再测pH,结果将 ▲ (填“变大”“变小”或“不变”)
第二组,用拟用下列装置定量分析空气中SO2的含量:

(5)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
该反应的现象是 ▲ ,SO2在该反应中显 ▲ (填“氧化”或“还原”)性。发生了 ▲ 反应(填“氧化”或“还原”)
(6)通入空气前应进行的实验操作是 ▲ ;KMnO4溶液中导管末端做成球状多孔结构的作用是 ▲
(7)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为 ▲ g/L


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com