
题目列表(包括答案和解析)
某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去。
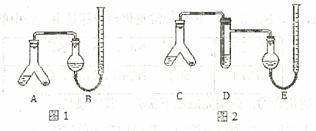
提供的试剂:研细的钙片粉末 (钙片中的其他成分不与盐酸反应)、![]() 盐酸、5%NaOH溶液、饱和
盐酸、5%NaOH溶液、饱和![]() 溶液、饱和
溶液、饱和![]() 溶液和蒸馏水。
溶液和蒸馏水。
实验过程:
Ⅰ.检查两套装置的气密性。
Ⅱ.在A、C的右边加入0.25g钙片粉末,左边加入3mL![]() 盐酸,塞紧塞子。在B、E中均加入饱和
盐酸,塞紧塞子。在B、E中均加入饱和![]() 溶液,如图所示,记下量气管读数。
溶液,如图所示,记下量气管读数。
Ⅲ.将A、C倾斜,使液体与固体混合,实验结束并冷却后读出量气管读数,测得B中收集到的气体为41.90mL,E中收集到的气体体积为39.20mL(以上气体体积均已折算为标准状况下的体积)。
回答下列问题:
(1)Ⅰ中检查图1装置气密性的万法是
。
(2)A中发生反应的离子方程式为 ;
D中加入试剂为 ,D的作用是 。
(3)实验前左右两管液面在同一水平面上,最后读数时右管的液面高于左管的液面,应进行的操作是
。
(4)图2实验所得钙片中的碳酸钙的质量分数为 ;图1实验比图 2实验所得钙片中的碳酸钙含量偏高,用离子万程式表示偏高的原因
。
依照阿伏加德罗定律,下列叙述正确的是
( ) A.同温同压下两种气体的体积之比等于摩尔质量之比。
B.同温同压下两种气体的物质的量之比等于密度之比。 C.同温同压下两种气体的摩尔质量之比等于密度之比。D.同温同体积下两种气体的物质的量之比等于压强之比。
设NA表示阿伏加德罗常数,下列说法不正确的是 ( )
A. 醋酸的摩尔质量与NA个醋酸分子的质量在数值上相等。
B.标准状况下,以任意比混和的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2 NA。
C.1L1mol/LCuCl2溶液中含有的Cu2+的个数为NA。
D.25℃,1.01×105Pa时,16g臭氧所含的原子数为NA。
设NA表示阿伏加德罗常数的数值,下列说法正确的是 ( )
A.用惰性电极电解500mL饱和食盐水时,若溶液的pH值变为14时,则电极上转移的电子数目为NA。
B.在标准状况下,各为1mol的二氧化硫、三氧化硫的体积均约为22.4L。
C. 在常温常压下,6g石英晶体中,含有0.4NA个硅氧共价键。
D.120g由NaHSO4和KHSO3组成的混合物中含有硫原子NA个。
标准状况下,下列混合气体的平均式量可能是50的是 ( )
A.硫化氢和二氧化硫 B.一氧化氮和氧气
C.二氧化硫和溴化氢 D.碘化氢和氯气
在一个恒容密闭容器中充入11gX气体(摩尔质量为 44g·mol-1),压强为1×105pa。如果保持温度不变,继续充入X气体,使容器内压强达到5×105pa。则此时容器内的气体X的分子数约为 ( )
A.3.3×1025 B.3.3×1024 C.7.5×1023 D.7.5×1022
由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同。则该混合气体中二氧化碳、氢气、一氧化碳的体积比为 ( )
A.29∶8∶13 B.22∶1∶14 C.13∶8∶29 D.26∶16∶57
同温、同压下,CO2 和NO的混合气体 20mL,通过足量过氧化钠后气体体积减少到10mL,则原混合气体的体积比可能是 ( )
A.1∶1 B.2∶3 C.3∶2 D.1∶4
乙炔和乙烯的混合气体完全燃烧时,所需氧气的体积是原混合气体的2.7倍,则该混合气体与足量的H2发生加成反应时,消耗H2的体积是原混合气体体积的 ( ) A.1.6倍 B.1.8倍 C.1.4倍 D.1.2倍
在一定条件下,将5体积NO、5体积NO2、6体积O2混合气体置于试管中,并将试管倒立于水槽中,充分反应后,剩余气体的体积是 ( )
A.1体积 B.2体积 C.3体积 4.4体积
19世纪,化学家对氧化锆的化学式有争议.经测定锆的相对原子质量为91,其氯化物蒸气的密度是同溶、同压下H2密度的116-117倍,试判断与氯化物价态相同的氧化锆的化学式 ( )
A.ZrO B.Zr2O C.Zr2O3 D.ZrO2
常温下,向20L真空容器中通入A mol硫化氢和 Bmol氯气(A,B均为不超过5的正整数),反应完全后,容器内气体可能达到的最大密度是 ( )
A.8.5 g·L-1 B.18.25g·L-1 C.18.5 g·L-1 D.35.5 g· L-1
(6分)某溶液由盐酸、Na2CO3、H2SO4、CuCl2四种物质中的一种或几种混合形成,现向该混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示。
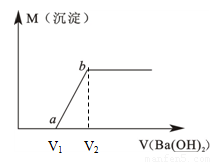
(1)该溶液中一定含 。(填化学式)
(2)写出图中a点之前的离子方程式: ;
写出图中a→b点的离子方程式: 。
(3)将所得沉淀进行过滤,洗涤,干燥,称量,应如何判断沉淀是否完全洗净:
。
(4)若b点时沉淀质量=2.94克,V1=20mL,V2=40mL,求C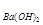 = 。
= 。
(16分)运用相关原理,回答下列各小 题:
题:
Ⅰ.已知NaHSO4在水中的电离方程式为NaHSO4=Na++ H++ SO4 2-。
2-。
(1)在NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填“>”、“=”或“< ”
” 下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
(2)将 20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
0.001 mol·L-1BaCl2溶液,首先析出的沉淀是 。[KSP(BaSO4)=1.1×10-10mol2·L-2;KSP(BaCO3)=5.1×10-9mol2·L-2]
Ⅱ.已知:在25时 H2O H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH
 H++CH3COO--> Ka=1.8×10-5
H++CH3COO--> Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 。当升高温度时,Kh将 (填“增大”“减小”“不变”);
(4)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)
 为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(5)0.9mol·L-1醋酸钠溶液中[OH-]= mol·L-1
在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14、 =2.2)
=2.2)
(6分)某溶液由盐酸、Na2CO3、H2SO4、CuCl2四种物质中的一种或几种混合形成,现向该混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示。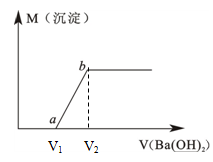
(1)该溶液中一定含 。(填化学式)
(2)写出图中a点之前的离子方程式: ;
写出图中a→b点的离子方程式: 。
(3)将所得沉淀进行过滤,洗涤,干燥,称量,应如何判断沉淀是否完全洗净:
。
(4)若b点时沉淀质量=2.94克,V1=20mL,V2=40mL,求C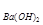 = 。
= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com