
题目列表(包括答案和解析)
| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞. ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 |
A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成淡黄色沉淀 |
| 实验方案 | 实验现象 | 有关离子方程式 |
③ ③ |
A | 2Na+2H2O=2Na++2OH-+H2↑ 2Na+2H2O=2Na++2OH-+H2↑ |
① ① |
B | 不填 |
⑤ ⑤ |
C | 不填 |
④ ④ |
D | 不填 |
② ② |
E | H2S+Cl2=2H++2Cl-+S↓ H2S+Cl2=2H++2Cl-+S↓ |
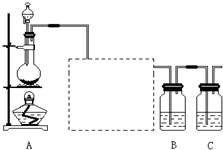 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

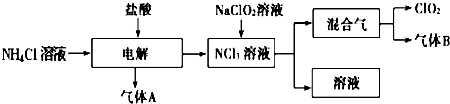
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:请回答下列问题。
(1)ClO2中所有原子?????? (填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用?????? 。
A.饱和食盐水????? B.碱石灰??????? C.浓硫酸??????? D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是????? 。
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,化学反应方程式为??????????????????????????? ,此法缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是????????????????????????? ,此法相比欧洲方法的优点是????????????????????????? 。
(5)科学家最近又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为????????????????????????????????????????????????????? ,此法提高了生产及储存、运输的安全性,原因是??????????????????????????????????????????????????? 。
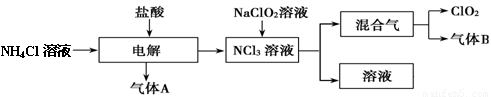
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或受热。实验室以电解法制备ClO2的流程如下:
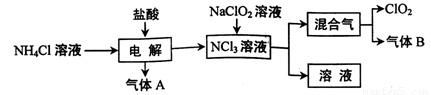
(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示方法制得的混合气中杂质气体B能使石蕊试液显蓝色,除去该杂质气体可选用 __;
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品。下列说法正确的是 ;
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,但该方法缺点是产率低、产品难以分离,还可能污染环境。写出该方法发生的化学方程式 ;
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是
,此法相比欧洲方法的优点是
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是____ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com