
题目列表(包括答案和解析)
(12分,每空2分) 现有A、B、C、D、E、F六种常见化合物,已知它们:阳离子分别有K+、Ag+、Na+、Ba2+、Fe2+、Al3+;阴离子分别有Cl-、OH-、AlO、NO、SO、CO。将它们分别配成0.1 mol/L的溶液进行如下实验:
①测得溶液A、C、E均呈碱性,且碱性:A>E>C,E的焰色呈浅紫色(透过蓝色钴玻璃观察);
②向B溶液中滴加稀氨水至过量,先生成沉淀,后沉淀全部溶解;
③向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成;
④向D溶液中滴加Ba(NO3)2溶液无明显现象。
(1)写出A、D、E、F的化学式:
A__________________;
D__________________;
E__________________;
F__________________。
(2)用离子方程式解释C溶液的碱性:________________________________________。
(3)写出实验③中反应的离子方程式:_________________________________________。
(12分,每空2分) 现有A、B、C、D、E、F六种常见化合物,已知它们:阳离子分别有K+、Ag+、Na+、Ba2+、Fe2+、Al3+;阴离子分别有Cl-、OH-、AlO、NO、SO、CO。将它们分别配成0.1 mol/L的溶液进行如下实验:
①测得溶液A、C、E均呈碱性,且碱性:A>E>C,E的焰色呈浅紫色(透过蓝色钴玻璃观察);
②向B溶液中滴加稀氨水至过量,先生成沉淀,后沉淀全部溶解;
③向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成;
④向D溶液中滴加Ba(NO3)2溶液无明显现象。
(1)写出A、D、E、F的化学式:
A__________________;
D__________________;
E__________________;
F__________________。
(2)用离子方程式解释C溶液的碱性:________________________________________。
(3)写出实验③中反应的离子方程式:_________________________________________。
(12分,每空2分) 现有A、B、C、D、E、F六种常见化合物,已知它们:阳离子分别有K+、Ag+、Na+、Ba2+、Fe2+、Al3+;阴离子分别有Cl-、OH-、AlO、 NO、SO、CO。将它们分别配成0.1 mol/L的溶液进行如下实验:
NO、SO、CO。将它们分别配成0.1 mol/L的溶液进行如下实验:
①测得溶液A、C、E均呈碱性,且碱性:A>E>C,E的焰色呈浅紫色(透过蓝色钴玻璃观察);
②向B溶液中滴加稀氨水至过量,先生成沉淀,后沉淀全部溶解;
③向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成;
④向D溶液中滴 加Ba(NO3)2溶液无明
加Ba(NO3)2溶液无明 显现象。
显现象。
(1)写出A、D、E、F的化学式:
A__________________;
D__________________;
E__________________;
F__________________。
(2)用离子方程式解释C溶液的碱性:________________________________________。
(3)写出实验③中反应的离子方程式:_________________________________________。
(1)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体易溶于水,则此种化合物是________(填“极性”、“非极性”)分子.
(2)今有A、B、C、D四种元素,它们的原子序数依次增大,且均小于18,A和B在同一周期,A原子p能级有一个空轨道,B原子的p能级有两个未成对电子,0.1 mol C单质能从酸中置换出2.24 L氢气(标准状态),此时它就变成与B离子电子层排布完全相同的离子.D离子的半径在B、C、D中为最小.则:
①A是________,B是________,C是________,D是________.(填名称)
②A单质和B单质充分反应生成的化合物的电子式是________.
③我国科学工作者于20世纪90年代在兰州制备出过去一直依赖进口,价格十分昂贵的B的一种同位素形成的单质,1 mol这种单质中含中子的物质的量是20 mol,则这种同位素原子的符号为________.
(3)NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,试判断溶于水后,形成的合理结构是________.(填下图中的字母)
NH4++OH-,试判断溶于水后,形成的合理结构是________.(填下图中的字母)

(4)把CoCl2溶于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+,此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示,Co的配位数是6.把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀.经测定,每1 mol CoCl3·5NH3只生成2 mol AgCl.CoCl3·5NH3中Co化合价为________,请写出表示此配合物结构的化学式:________.
(5)核内中子数为N的R2+,质量数为A,则ng它的氧化物中所含质子的物质的量是________.
(6)Mg晶体的熔点比Na晶体________(填“高”或“低”),原因是________.
(17分)
(1)大气中SO2含量过高会导致雨水中含有 (填化学式)而危害植物和建筑物。工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反应的化学方程式为 。
(2)SO2是空气质量报告的指标之一,可用SO2还原KIO3生成I2的反应测定空气中SO2含量。每生成0.01mol I2,参加反应的SO2为 mol。
 (3)合成氨的反应N2(g)+3H2(g)
(3)合成氨的反应N2(g)+3H2(g) 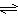 2NH3(g) △H = -92.4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
2NH3(g) △H = -92.4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a.升高温度 b.加入催化剂 c.增加H2的浓度
d.增加N2的浓度 e.分离出NH3  (4)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。 (5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com