
题目列表(包括答案和解析)
在21℃和充分搅拌下,将不同体积1.0 mol·L—1 HCl溶液和未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下:
| 盐酸的体积V(mL) | 5.0 | 10.0 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 | 40.0 | 45.0 |
| NaOH的体积(mL) | 45.0 | 40.0 | 35.0 | 30.0 | 25.0 | 20.0 | 15.0 | 10.0 | 5.0 |
| 溶液温度t(℃) | 22.2 | 23.3 | 24.6 | 25.8 | 27.0 | 27.8 | 26.1 | 24.4 | 22.8 |
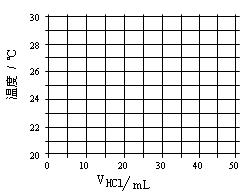 (1)在给定的坐标图上绘出溶液温度与盐酸体积的关系图。
(1)在给定的坐标图上绘出溶液温度与盐酸体积的关系图。
(2)假定酸碱恰好完全反应前后,溶液温度与盐酸体积可以近似
地认为呈线性关系。请写出溶液温度t与盐酸体积V的线性
关系式(请用含有t和V的式子表示) 、 。
(3)所用NaOH溶液的物质的量浓度= 。
备用 . 四氧化三铅俗名“铅丹”或“红丹”,由于有氧化性被大量地用于油漆船舶和桥梁钢架防锈,其化学式可写为2PbO·PbO2。欲测定某样品中四氧化三铅含量,进行如下操作:
①称取样品0.1000g,加酸溶解,得到含Pb2+的溶液。
②在加热条件下用过量K2Cr2O7将Pb2+沉淀为PbCrO4,冷却后过滤洗涤沉淀。
③将PbCrO4沉淀用酸溶液溶解(沉淀溶解的离子方程式为:2PbCrO4+2H+=
2Pb2+Cr2O72-+H2O),加入过量KI,再用0.1000mol·L―1 Na2S2O3溶液滴定,到滴定终点时用
去12.00mL(滴定过程中离子方程式为:I2+2S2O32-=2I-+S4O62-)。
则:(1)写出步骤③中加入过量KI后溶液中发生的离子反应方程式 。
(2)用标准溶液滴定时所用的指示剂是 。(写试剂名称)
(3)计算试样中Pb3O4的质量分数。(Pb的相对原子质量为207.2)

 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 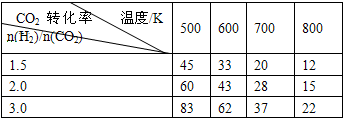


 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 

| 温度溶解度盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| c(V2-V1)M |
| 1000W |
| c(V2-V1)M |
| 1000W |
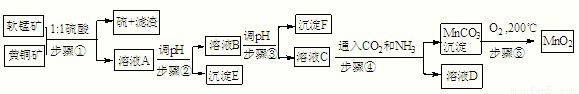
| Cu(OH)2 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 | |
| 开始沉淀pH | 4.2 | 1.5 | 7.3 | 6.4 |
| 完全沉淀pH | 6.7 | 3.2 | 9.8 | 9.0 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com