
题目列表(包括答案和解析)
| ||
| ||
| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
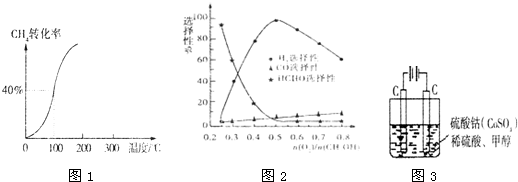
 (1)甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
(1)甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
(8分)(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g ) =CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g ) = CH3OH ( g ) △H =—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:

①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的电极反应式
负极 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com