
题目列表(包括答案和解析)
 (2013?大连模拟)向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如右图,则原混合溶液中MgCl2与FeCl3的物质的量之比为( )
(2013?大连模拟)向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如右图,则原混合溶液中MgCl2与FeCl3的物质的量之比为( )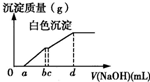 向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如图所示,则原混合溶液中MgCl2与FeCl3的物质的量之比为( )
向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如图所示,则原混合溶液中MgCl2与FeCl3的物质的量之比为( )熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求。试回答下列问题:
(1)在仪器a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是 (填序号)。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,在下列仪器中,没有用到“磨砂”工艺处理的有 (填序号)。
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶) d.集气瓶 e.酸式滴定管 f.碱式滴定管
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体,可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。试回答下列问题:

①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为 ,制取该气体利用了B的性质有 、 。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为 。
②若在乙中收集氨气,气体流经装置的顺序是:a



 d(填接口代号)。
d(填接口代号)。
| A.原子半径A>B>D>C | B.a+2=b+1=c-3=d-1 |
| C.离子半径C>D>B>A | D.原子序数A>B>D>C |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com