
题目列表(包括答案和解析)
SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如下图所示实验装置。

(1).检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后_______________________________________(填写操作方法)时,将会看到________________(填写实验现象),则证明该装置的气密性良好( )
A.向外轻轻拉动注射器的活塞 浸没在水中的玻璃导管口有气泡冒出
B.向内轻轻推动注射器的活塞 浸没在水中的玻璃导管口有气泡冒出
C.向外轻轻拉动注射器的活塞 浸没在水中的玻璃导管口有水柱上升
D.手握试管 浸没在水中的玻璃导管口有气泡冒出
(2).向试管中加入0.000 5 mol/L碘水1.0 mL,用适量的蒸馏水稀释后再加入2~3滴淀粉溶液,配制成溶液A。测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气,A溶液由________色变成______色时反应恰好完全进行,此时停止抽气( )
A.红 无 B.无 红 C.蓝 无 D.无 蓝
(3).我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值如下表:
|
浓度限值/mg/m3 |
||
|
一级标准 |
二极标准 |
三级标准 |
|
0.15 |
0.50 |
0.70 |
该学生课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A。在同一地点、同时测量空气中SO2的含量。反应恰好完全进行,记录抽气次数和结果如下(假设每次抽气500 mL)。
|
分组 |
第一小组 |
第二小组 |
|
抽气次数 |
100 |
120 |
|
SO2含量/mg/m3 |
0.64 |
0.53 |
____小组的测定结果正确( )
A.第一 B.第二
C.都正确 D.都不正确
(4).判断该地点的空气中SO2的含量属于________标准( )
A.一级 B.二级 C.三级 D.四级
(5).实验结果产生较大偏差的原因是(所用装置和药品均无问题)( )
A.抽气速度过快,造成空气中SO2无法与碘水充分反应,产生较大的误差
B.抽气速度过慢,造成空气中SO2无法与碘水充分反应,产生较大的误差
C.装置漏气,造成空气中SO2无法与碘水充分反应,产生较大的误差
D.抽气速度过快,造成空气中O2与碘水充分反应,产生较大的误差
钛由于具有密度小、强度高、耐高温、抗腐蚀性强等优点,在现代科学技术上有着广泛的用途。工业上常用钛铁矿(主要成分为FeTiO3,同时含有铁的氧化物)为原料,经过一系列反应来制得钛,其流程大致如下。其中反应②目的是使Ti4+与水作用生成Ti(OH)4沉淀。阅读下述流程,完成下列填空: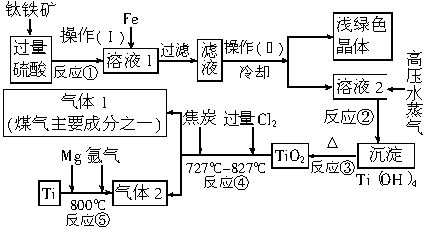
(1)操作(Ⅰ)中Fe的作用是____________,反应的离子方程式是_________________。
(2)操作(Ⅱ)的名称是______,得到的浅绿色晶体的化学式是__________________。
(3)写出反应④总的化学方程式(最终Ti的化合价不变):_____________________________。
(4)写出反应⑤的化学方程式:______________,
通入氩气的作用是____________________________。
(5)根据所提供的有关信息,你认为钛的用途之一是(指尖端科学技术)________________________。
(1)写出上述内容涉及的化学方程式。
(2)制取甲硅烷的装置与制取________(填“氧气”“氢气”或“氯气”)的装置相似。
(3)加入稀盐酸之前应向密闭装置中通入一会儿氮气,其目的是______________。
(4)收集甲硅烷气体只能采用________法,这是因为________。收集完甲硅烷气体后不能直接将导气管从水槽中取出,这是为了防止________,正确的操作方法是________________。
(5)为了研究甲硅烷的化学性质,进行如下实验:①将甲硅烷通入少量的高锰酸钾酸性溶液中,发现有二氧化锰生成,同时还生成了所有气体中最轻的气体,然后经测定得知所得溶液为无色的硅酸钾(K2SiO3)溶液,该反应的化学方程式为_______________________。②将甲硅烷通入少量的硝酸银溶液,发现有沉淀生成,然后经测定得知沉淀为混合物,其中有二氧化硅。向充分反应后的溶液中滴入几滴稀盐酸,未发现有白色沉淀生成;向反应后的原溶液中滴入几滴碳酸钠溶液,却发现有气泡迅速放出。则将甲硅烷通入硝酸银溶液中,发生反应的化学方程式为____________________________________。
(6)制完甲硅烷后,检验装置中是否有残留的甲硅烷的方法是_________________________。
(16分)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)一定条件下,在一个密闭容器中充入气体:N2 2mol、H2 6mol,达平衡后N2的转化率为50%,同时放热92.3KJ。该反应的热化学方程式为:______________________________。
(2)传统哈伯法合成氨工艺中相关的反应式为:N2+3H22NH3 。
①该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据, (填温度和压强)。时H2转化率最高,实际工业生产中不选用该条件的主要原因是 。
③下列关于合成氨说法正确是 (填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(3)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,你认为电解质溶液应显 性(填“酸性”、“中性"、“碱性”),写出负极电极反应式 。
(4)工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
(16分)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)一定条件下,在一个密闭容器中充入气体:N2 2mol、H2 6mol,达平衡后N2的转化率为50%,同时放热92.3KJ。该反应的热化学方程式为:______________________________。
(2)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2 2NH3。
2NH3。
①该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据, (填温度和压强)。时H2转化率最高,实际工业生产中不选用该条件的主要原因是 。
③下列关于合成氨说法正确是 (填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(3)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,你认为电解质溶液应显 性(填“酸性”、“中性"、“碱性”),写出负极电极反应式 。
(4)工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com